Die EU-Kommission gab einer breit gefächerten Gruppe an Interessensträgern von Dezember 2024 bis März 2025 die Möglichkeit, “Rückmeldungen zu Wirksamkeit, Effizienz, Relevanz, Kohärenz und EU-Mehrwert der Verordnungen über Medizinprodukte” abzugeben. Die betreffenden Verordnungen waren die MDR sowie die IVDR.
Knapp 60 % der Rückmeldungen kamen dabei aus Unternehmen. Fast 45 % aller Rückmeldungen kamen alleine aus Deutschland und Frankreich.
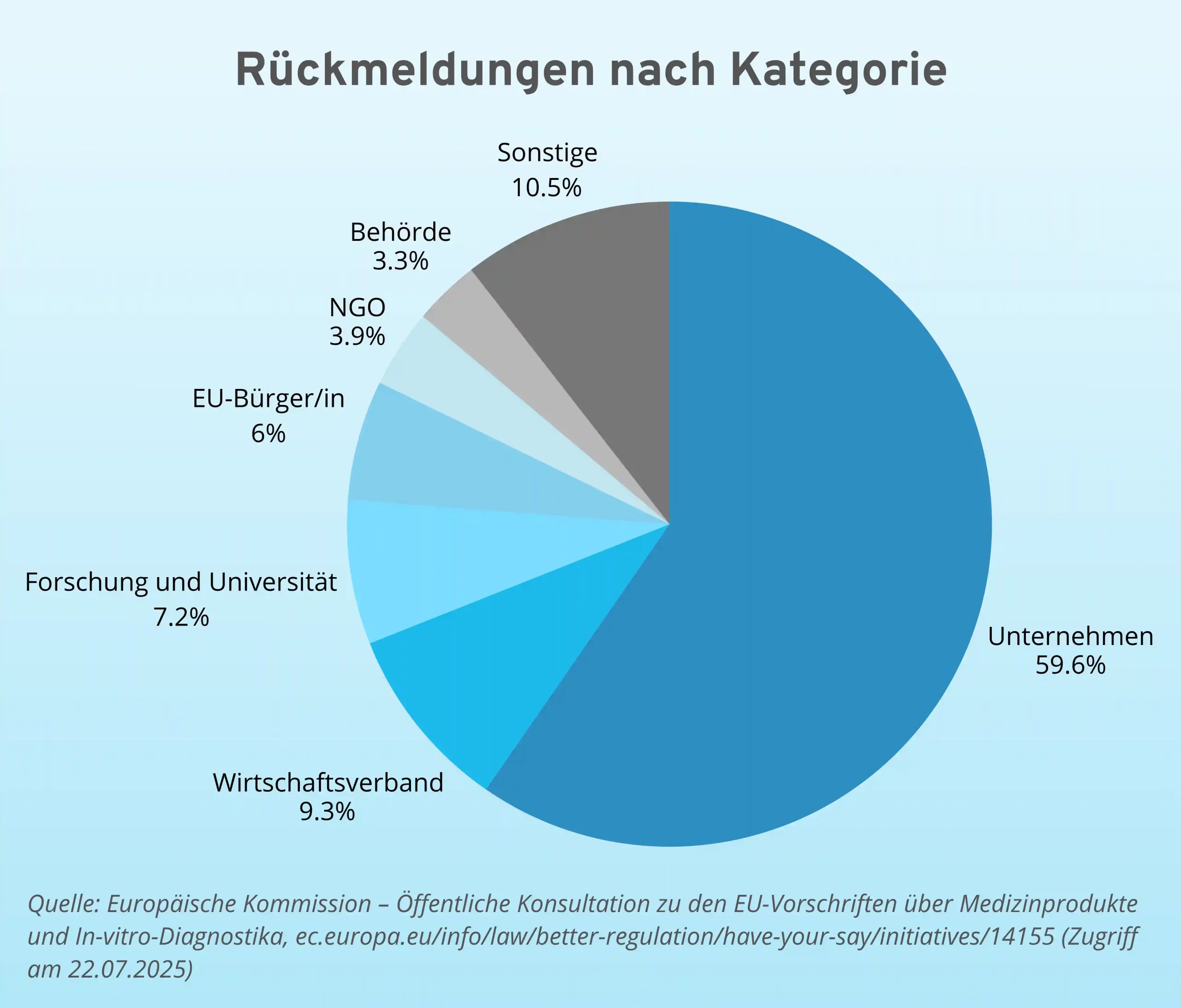
Die Bewertung der MDR ohne Berücksichtigung von Einzelbeträgen aus der Bevölkerung lässt sich laut veröffentlichtem Bericht wie folgt zusammenfassen:
Knapp die Hälfte der Befragten ist der Ansicht, dass die MDR zur Sicherheit von Patienten und Anwendern beiträgt. Gleichzeitig kritisiert jedoch ein großer Teil der Unternehmen, dass die MDR keine positiven Effekte auf die Innovations- und Wettbewerbsfähigkeit der EU erzielt habe.
Nur wenige sehen in der MDR einen echten Binnenmarkt mit gleichen Wettbewerbsbedingungen für alle, da insbesondere Unternehmensgröße und Marktposition weiterhin zu Ungleichheiten führen.
Positiv hervorgehoben wurde hingegen der Vorteil, dass unter der MDR die Einhaltung unterschiedlicher nationaler Regularien innerhalb der EU entfällt: Etwa die Hälfte der Befragten gab an, dadurch geringere Compliance-Kosten zu haben. Dennoch werden die mit den MDR-Vorgaben verbundenen Kosten vornehmlich in der Phase vor dem Inverkehrbringen eines Medizinprodukts überwiegend als hoch und inakzeptabel eingeschätzt.
Der Abschlussbericht lässt sich hier downloaden: https://ec.europa.eu/info/law/
