DiGA Entwicklung 2025: Ihr Weg ins BfArM-Verzeichnis
Sie planen die Entwicklung einer DiGA? Dann vereinbaren Sie jetzt ein unverbindliches Beratungsgespräch. Wir übernehmen die Software-Entwicklung, die Einhaltung aller regulatorischen Anforderungen und unterstützen Sie auf Ihrem Weg ins DiGA-Verzeichnis des BfArM.
Unsere Roadmap zur DiGA-Entwicklung
Der Weg ins DiGA-Verzeichnis ist voller Herausforderungen. Als zuverlässiger Partner begleiten wir Sie von der Idee, über die Software-Entwicklung bis zur Listung Ihrer DiGA im Verzeichnis des BfArM.
Whitepaper für angehende Hersteller
In unserem Whitepaper finden Sie die wichtigsten Tipps für DiGA-Hersteller in 2024
- Entwicklung, Zulassung, Studie und Vertrieb Ihrer DiGA
- Unsere Erfahrungen aus zahlreichen DiGA-Projekten
- Praxisnahe Ratschläge für angehende DiGA-Hersteller
- Die maßgebenden Risiken für die Zulassung beim BfArM
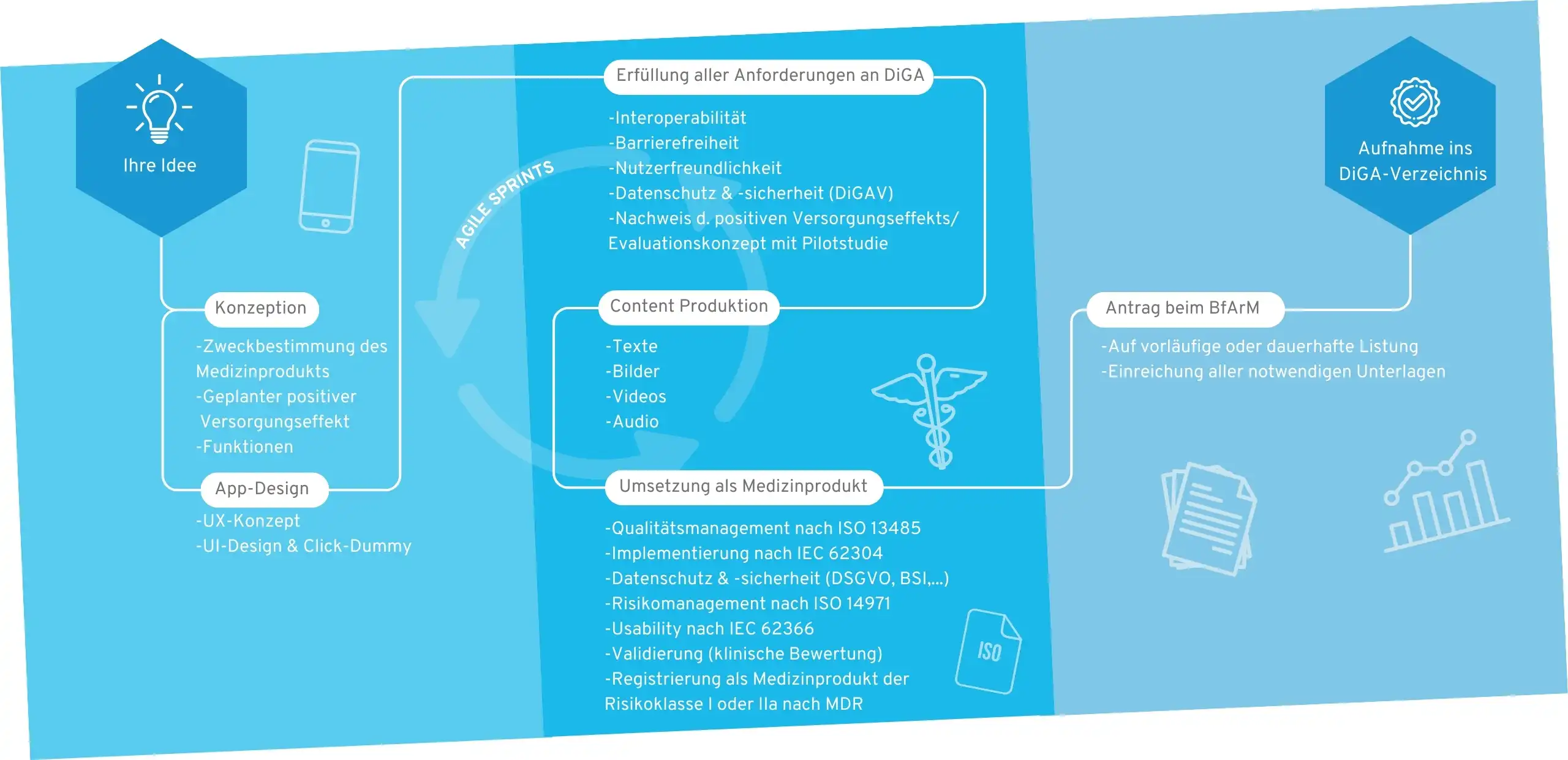
Ihr Weg in das DiGA-Verzeichnis
1. Konzeption
Nach der zündenden Idee beginnt die Konzeption, in der die Zielgruppe, der Nutzen, die medizinische Zweckbestimmung und die Anforderungen an Ihre DiGA definiert werden.
UX- und User Research-Spezialisten


2. User Interface Design
Ein professionelles App-Design macht Ihre App zum ersten Mal greifbar und dient als unerlässliches Fundament zur Umsetzung des Projekts. Zur Visualisierung erstellen wir Wireframes und einen initialen Click-Dummy, der im Anschluss mit Funktionalität gefüllt wird.
3. MDR-konforme DiGA-Entwicklung
Der Regulatorik-Dschungel ist für viele DiGA-Hersteller zu Beginn undurchsichtig, denn sowohl die DiGAV als auch die MDR stellen viele Anforderungen. In diesem Schritt werden die Funktionalitäten Ihrer DiGA schrittweise von uns entwickelt und durchlaufen dabei unsere Qualitätsmanagement-Prozesse nach ISO 13485 und IEC 62304.


4. Content Production
Eine medizinische App benötigt guten Content. Sobald die wissenschaftliche Evidenz für die Inhalte gegeben ist, werden diese in multimediale Formate übersetzt. Wir unterstützen Sie bei der Erstellung von Bildern, Videos, Texten und anderen visuellen Elementen für ein einzigartiges Nutzererlebnis.
5. Umsetzung als Medizinprodukt
Anschließend wird Ihre App als Medizinprodukt der Klasse I, IIa oder IIb nach MDR registriert. Wir begleiten Sie durch diesen Prozess und unterstützen Sie bei der Suche nach einer benannten Stelle, falls nötig.


6. BfArM Zulassung
Wir unterstützen Sie bei der Antragstellung beim BfArM und bereiten alle Unterlagen vor. Nachdem die App vom BfArM hinsichtlich Sicherheit, Funktionalität, Qualität, Datensicherheit und Datenschutz geprüft wurde (Fast-Track-Verfahren), erfolgt eine vorläufige Erstattung durch die gesetzliche Krankenversicherung für einen Zeitraum von einem Jahr.
7. Aufnahme ins DiGA-Verzeichnis
Nun wird Ihre DiGA wird im BfArM-Verzeichnis gelistet und kann von den Krankenkassen erstattet werden. Wir übernehmen regelmäßige Software-Updates und die Wartung Ihres Produkts.
Zusätzlich bieten wir Beratung zur Vermarktung Ihrer DiGA an, um mehr PatientInnen zu erreichen.

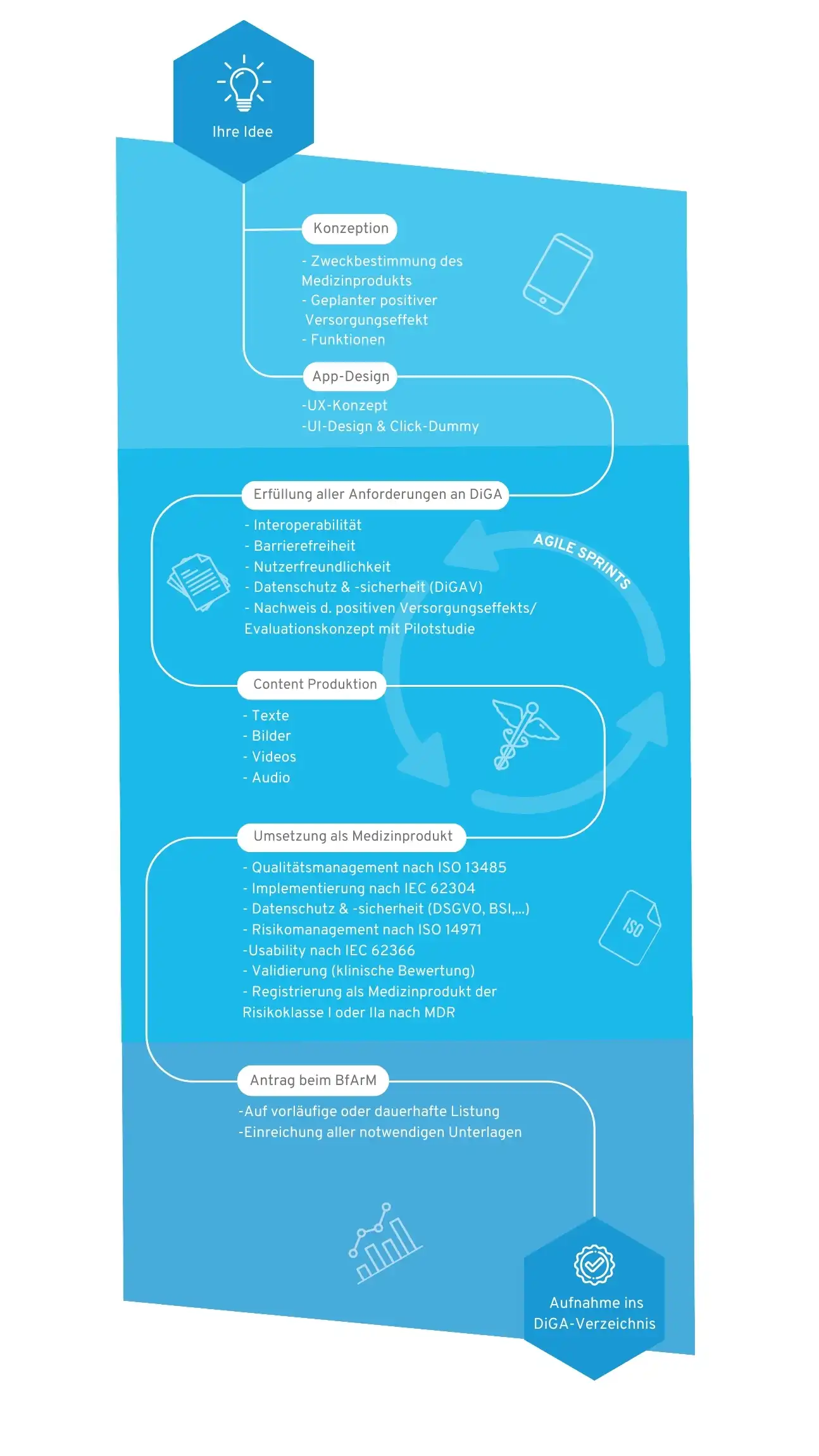
Ihr Weg in das DiGA-Verzeichnis

1. Konzeption
Nach der zündenden Idee beginnt die Konzeption, in der die Zielgruppe, der Nutzen, die medizinische Zweckbestimmung und die Anforderungen an Ihre DiGA definiert werden.
UX- und User Research-Spezalisten

2. User Interface Design
Ein professionelles App-Design macht Ihre App zum ersten Mal greifbar und dient als unerlässliches Fundament zur Umsetzung des Projekts. Zur Visualisierung erstellen wir Wireframes und einen initialen Click-Dummy, der im Anschluss mit Funktionalität gefüllt wird.

3. MDR-konforme DiGA-Entwicklung
Der Regulatorik-Dschungel ist für viele DiGA-Hersteller zu Beginn undurchsichtig, denn sowohl die DiGAV als auch die MDR stellen viele Anforderungen. In diesem Schritt werden die Funktionalitäten Ihrer DiGA schrittweise von uns entwickelt und durchlaufen dabei unsere Qualitätsmanagement-Prozesse nach ISO 13485 und IEC 62304.

4. Content Production
Eine medizinische App benötigt guten Content. Sobald die wissenschaftliche Evidenz für die Inhalte gegeben ist, werden diese in multimediale Formate übersetzt. Wir unterstützen Sie bei der Erstellung von Bildern, Videos, Texten und anderen visuellen Elementen für ein einzigartiges Nutzererlebnis.

5. Umsetzung als Medizinprodukt
Anschließend wird Ihre App als Medizinprodukt der Klasse I, IIa oder IIb nach MDR registriert. Wir begleiten Sie durch diesen Prozess und unterstützen Sie bei der Suche nach einer benannten Stelle, falls nötig.

6. BfArM Zulassung
Wir unterstützen Sie bei der Antragstellung beim BfArM und bereiten alle Unterlagen vor. Nachdem die App vom BfArM hinsichtlich Sicherheit, Funktionalität, Qualität, Datensicherheit und Datenschutz geprüft wurde (Fast-Track-Verfahren), erfolgt eine vorläufige Erstattung durch die gesetzliche Krankenversicherung für einen Zeitraum von einem Jahr.

7. Aufnahme ins DiGA-Verzeichnis
Nun wird Ihre DiGA wird im BfArM-Verzeichnis gelistet und kann von den Krankenkassen erstattet werden. Wir übernehmen regelmäßige Software-Updates und die Wartung Ihres Produkts.
Zusätzlich bieten wir Beratung zur Vermarktung Ihrer DiGA an, um mehr PatientInnen zu erreichen.
Was uns besonders auszeichnet
ISO 13485 zertifiziert
Unser Qualitätsmanagementsystem ist nach ISO 13485 zertifiziert. Damit stellen wir eine konforme Entwicklung ihrer DiGA sicher und erfüllen die Anforderungen der MDR an Qualitätsmanagementsysteme.
Datenschutz und Datensicherheit
QuickBird Medical ist nach ISO 27001 für Informationssicherheit zertifiziert. Wir sind Experten im Bereich Cybersecurity und Datenschutz für Gesundheitsdaten.
Externe Inverkehrbringung
Bei Bedarf übernehmen wir für Ihre DiGA die Rolle des legalen Herstellers. Wir tragen somit die rechtliche Verantwortung für die Einhaltung aller regulatorischen Anforderungen der MDR. So können Sie sich auf Ihre Kernkompetenzen wie Vertrieb & Vermarktung konzentrieren.
QuickBird Medical erhält erste BSI TR-03161-Zertifizierung
QuickBird Medical hat gemeinsam mit einem Kunden eine DiGA (im Antrag) entwickelt. Nach intensiver Vorbereitung, sorgfältiger Implementierung und enger Zusammenarbeit mit der Prüfstelle ist es am 2. Juni 2025 gelungen: Die Anwendung erhielt als erste DiGA überhaupt das neue BSI-Zertifikat nach TR-03161. Ein wichtiger Meilenstein für die gesamte DiGA-Szene.
QuickBird Medical erhält erste BSI TR-03161-Zertifizierung
QuickBird Medical hat gemeinsam mit einem Kunden eine DiGA (im Antrag) entwickelt. Nach intensiver Vorbereitung, sorgfältiger Implementierung und enger Zusammenarbeit mit der Prüfstelle ist es am 2. Juni 2025 gelungen: Die Anwendung erhielt als erste DiGA überhaupt das neue BSI-Zertifikat nach TR-03161. Ein wichtiger Meilenstein für die gesamte DiGA-Szene.
Unsere Medical Software und DiGA Kunden
Sie planen die Umsetzung einer DiGA?
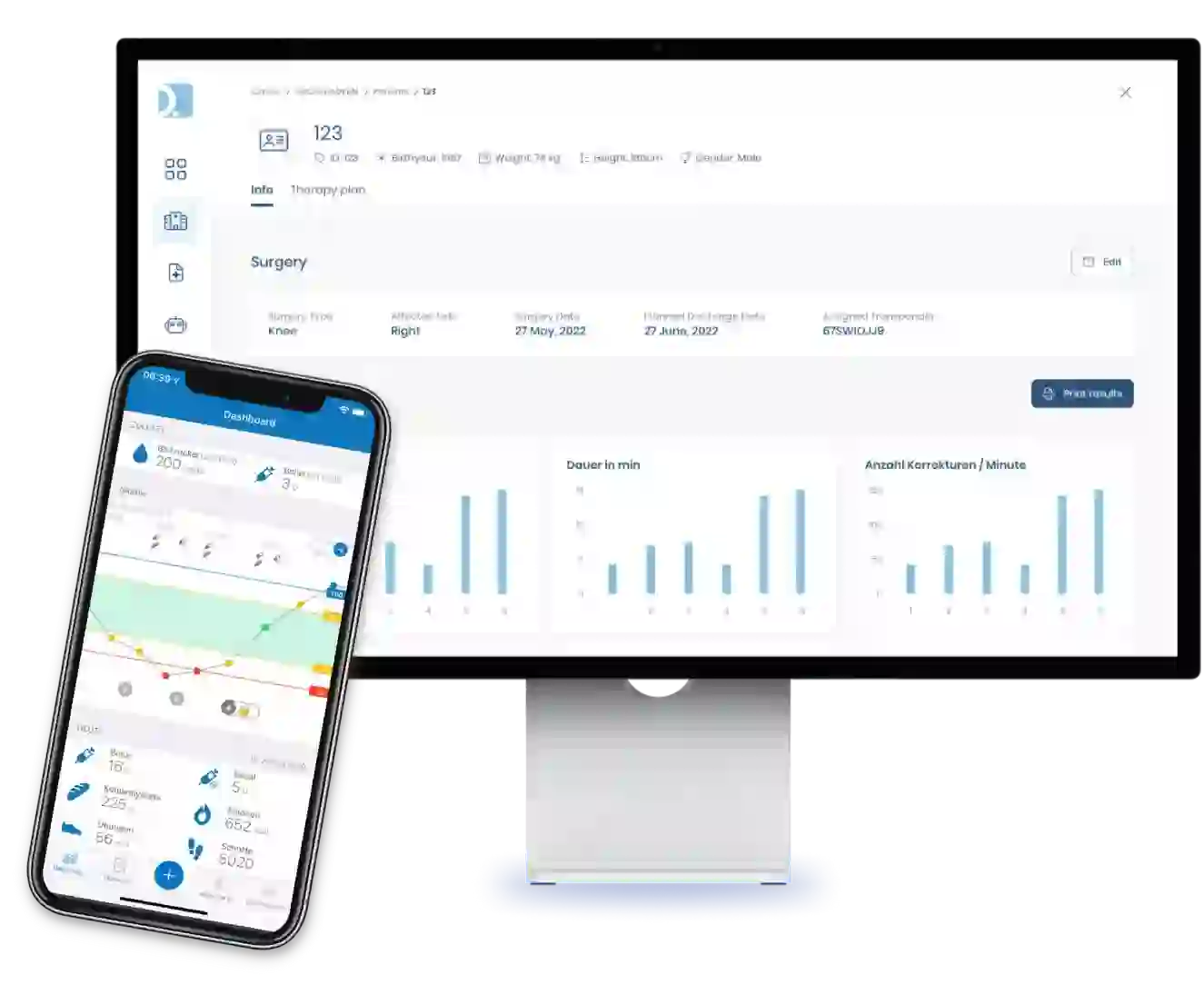
Unser Team unterstützt Sie bei der Planung und technischen Umsetzung Ihrer Anwendung. Dabei profitieren Sie von unserer Erfahrung in der Implementierung aller regulatorischen Anforderungen an DiGA. Sprechen Sie uns an und vereinbaren Sie ein unverbindliches Erstgespräch. Lassen Sie uns gemeinsam herausfinden, wie wir Sie auf Ihrem Weg ins DiGA-Verzeichnis unterstützen können.


