In der aktuell gültigen Version der Medical Device Regulation (MDR) herrscht bei der Klassifizierung von Software-Medizinprodukten viel Interpretationsspielraum. Speziell die Unterscheidung zwischen Risikoklasse I und IIa ist schwammig formuliert. Hersteller, Behörden und benannte Stellen haben unterschiedliche Interpretationen hierzu.
Die EU-Kommission hat nun am 16. Dezember 2025 einen Änderungsvorschlag zur Medical Device Regulation (MDR) veröffentlicht. Unter anderem beinhaltet dieser Änderungsentwurf eine Änderung der berüchtigten Regel 11 zur Klassifizierung von Software-Medizinprodukten.
Die große Frage für Hersteller von digitalen Gesundheitsanwendungen (DiGA) und Medical Software: Welche Software-Produkte fallen unter dem neuen Entwurf in Klasse I, welche in Klasse IIa?
Eines der Ziele dieses Änderungsvorschlags zur MDR, ist laut EU-Kommission, Innovationen zu fördern. Daher liegt die Annahme nahe, dass im neuen Entwurf jetzt klar geregelt wird, dass Produkte mit niedrigem Risiko auch in Risikoklasse I fallen. Wie Sie weiter unten lesen können, ist dem vermutlich leider nicht so.
Wir haben uns den Entwurf und alle in diesem Bezug relevanten Dokumente im Detail angesehen. In diesem Artikel liefern wir Antworten zur aktuell geplanten Klassifizierung von Software-Medizinprodukten.
Inhaltsverzeichnis
- 1. Aktueller Stand: Klassifizierung von Software-Medizinprodukten
- 2. Geplanter Entwurf: Änderung der Regel 11 für Software-Medizinprodukte
- 3. Interpretationen der MDR-Änderungen zur Risikoklassifizierung
- 4. Was fällt noch in Risikoklasse I mit dem Draft für Änderungen der MDR?
- 5. Ist dieser Änderungsvorschlag final und wird er so umgesetzt?
- 6. Zeitplan: Ab wann gelten die MDR-Änderungen und die neue Regel 11?
- 7. Weitere Interpretationen
- 8. Fazit
1. Aktueller Stand: Klassifizierung von Software-Medizinprodukten
Bis die geplanten Änderungen in irgendeiner Form in der MDR landen, gelten natürlich die aktuellen Bestimmungen erst einmal weiter. In diesem Zusammenhang haben wir drei detaillierte Leitfäden geschrieben, welche Software-Medizinprodukt-Herstellern bei der Einordnung in eine MDR-Risikoklasse helfen:
- Klassifizierung von Software-Medizinprodukten: MDR-Leitfaden
- Klasse I Software nach MDR – Geht das noch?
- MDR Risikoklasse I vs. IIa: Unterschiede für Software-Medizinprodukte
2. Geplanter Entwurf: Änderung der Regel 11 für Software-Medizinprodukte
Der wohl wichtigste Teil der MDR in Bezug auf die Klassifizierung von Software-Medizinprodukten ist die Regel 11. Diese Regel soll sich nun grundlegend ändern.
Den aktuellen Entwurf für diese Änderung finden Sie hier: Annex zum Proposal for a regulation to simplify rules on medical and in vitro diagnostic devices
Der neue Wortlaut der Regel 11 würde dann wie folgt lauten:
6.3 Rule 11
Software which is intended to generate an output that confers a clinical benefit and is used for diagnosis, treatment, prevention, monitoring, prediction, prognosis, compensation or alleviation of a disease or condition is classified as class I, unless the output is intended for a disease or condition:
- in a critical situation with a risk of causing death or an irreversible deterioration of a person’s state of health, in which case it is classified as class III;
- in a serious situation with a risk of causing a serious deterioration of a person’s state of health or a surgical intervention, or to drive clinical management in a critical situation in which cases it is classified as class IIb;
- in a non-serious situation, or to drive clinical management in a serious situation or to inform clinical management in a critical or serious situation in which cases it is classified as class IIa.’;
Gemäß der vorgeschlagenen Regel landet also jede Software zunächst in Klasse I, sofern keine höherklassifizierenden Kriterien greifen. Dies ist eine Umkehrung der bisherigen Logik und klingt aus Herstellersicht erst einmal begrüßenswert. Es klingt beinahe so, als wäre Klasse I eher die Regel als eine Ausnahme bei Software-Medizinprodukten. Bei genauerer Betrachtung lässt sich dieser Eindruck aber nicht unbedingt bestätigen.
3. Interpretationen der MDR-Änderungen zur Risikoklassifizierung
Unser Experten-Team kam bei der Analyse der vorgeschlagenen Regel 11 zu zwei möglichen Auslegungen.
Zur Interpretation der Regel verwenden wir neben dem reinen Wortlaut auch folgende Dokumente:
- MDCG 2019-11 Rev.1: Das quasi-offizielle Guidance-Dokument zur Klassifizierung und Qualifizierung von Software-Medizinprodukten unter der MDR. Hier ist insbesondere die Tabelle in Annex III relevant, in welcher auf die Risikoklassifizierung der IMDRF verwiesen wird.
- IMDRF – Software as a Medical Device: Possible Framework for Risk Categorization and Corresponding Considerations: Internationales Rahmenwerk zur risikobasierten Einordnung von SaMD. Es bewertet Software anhand der klinischen Bedeutung der erzeugten Information und der Schwere der medizinischen Situation und bildet die konzeptionelle Grundlage für die Software-Klassifizierung in der MDCG 2019-11.
Diese Dokumente helfen beim Verständnis zentraler Begriffe (z.B. „critical situation“, „drive clinical management“) des MDR-Änderungsvorschlags und beinhalten die unten verwendeten Tabellen.
3.1 Interpretation 1: Strenge Auslegung
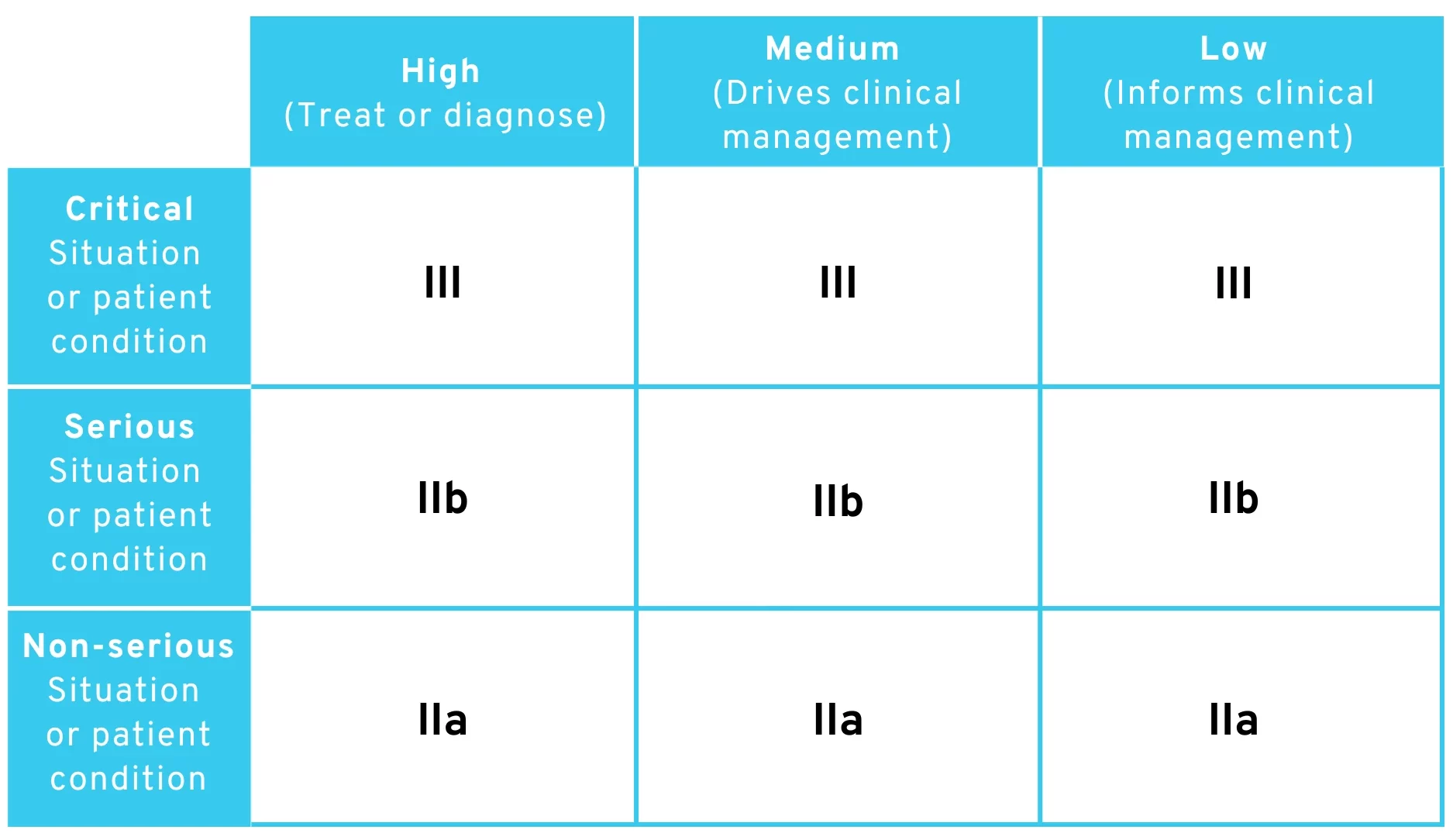
Streng genommen kann man die Regel so lesen, dass einfach jede Software, die
- … in einer „critical situation“ verwendet wird, in Klasse III fällt.
- … in einer „serious situation“ verwendet wird, in Klasse IIb fällt.
- … in einer „non-serious situation“ verwendet wird, in Klasse IIa fällt.
Jegliche Ausnahmen (z.B. „to drive clinical management in a critical situation […] is classified as class IIb“) werden bei dieser Auslegung nicht berücksichtigt. Laut MDR gilt bezüglich der Klassifizierung nämlich immer die strengste anwendbare (Sub-)Regel. Demnach könnte man die neue Regel so auslegen, dass immer die allgemeine Regel zur Einordnung in die höhere Risikoklasse greift.
Gemäß dieser Auslegung würde man zu folgender Einstufung der Risikoklassen kommen:
Änderungsvorschlag der MDR-Regel 11 – Tabelle zur Einstufung der Risikoklassen mit strenger Auslegung
Wie Sie sehen, fehlt hier die Risikoklasse I komplett. Es gibt keine offensichtliche Argumentation, um Software in diesem Fall noch der Klasse I zuzuordnen.
Diese Auslegung scheint uns aber sehr unwahrscheinlich, da der Wortlaut der Regel 11 in diesem Fall sehr viel einfacher sein könnte und sich die EU-Kommission bestimmt etwas bei den Ausnahmen und Zusätzen gedacht hat. Rechtlich gesehen ist auch fraglich, ob man die Unterpunkte der Regel 11 als „Unterregeln“ im Sinne der MDR-Durchführungsvorschrift 3.5 bezeichnen kann (wonach quasi immer die strengste Unterregel zu Klassifizierung anzuwenden ist).
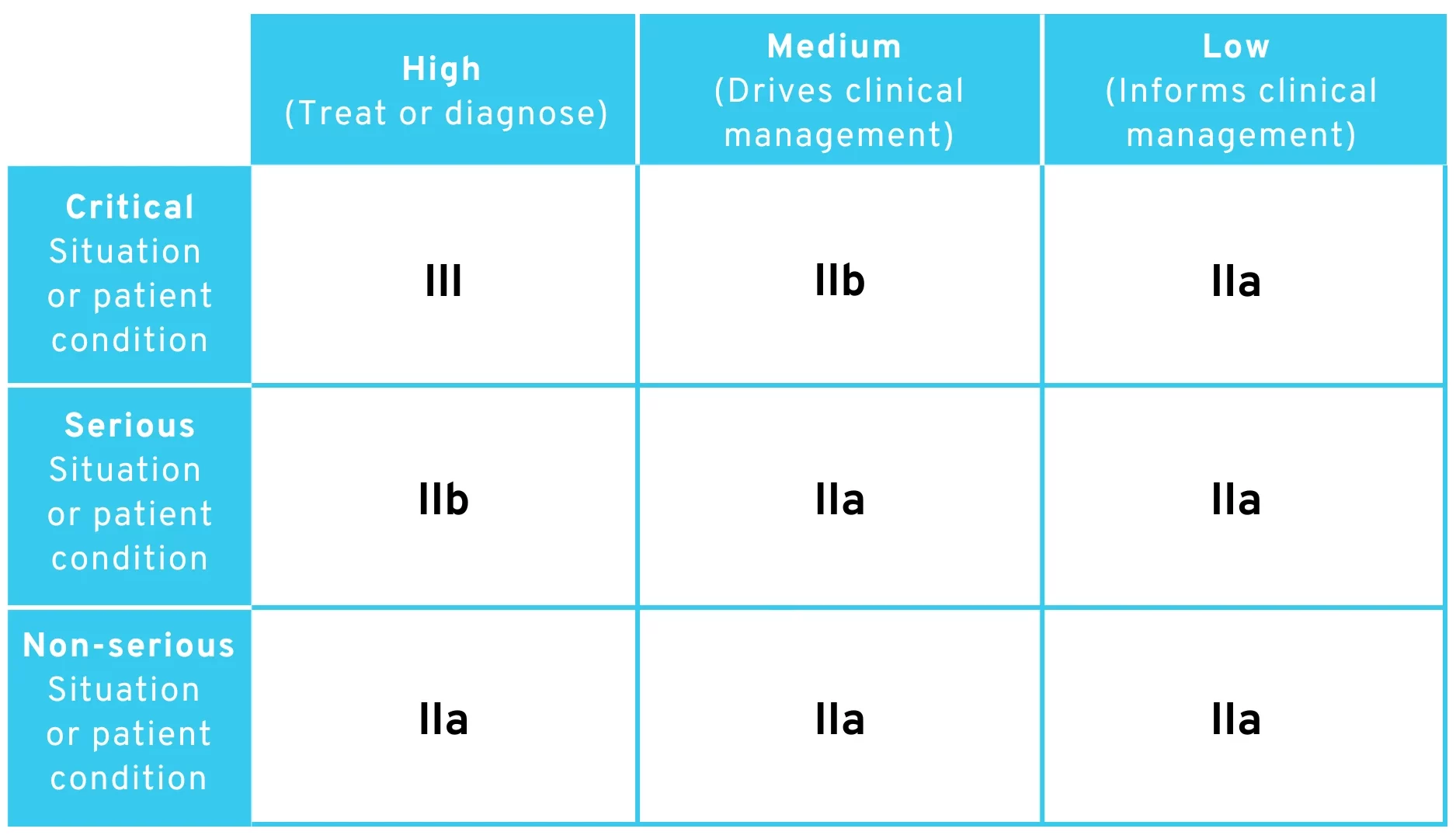
3.2 Interpretation 2: Wörtliche Auslegung
Man könnte die Regel zunächst genauso wie oben auslegen. Berücksichtigt man dann zusätzlich die explizit genannten Ausnahmen (z.B. “to drive clinical management in a critical situation […] it is classified as class IIb”), kommt man exakt zu der Tabelle in der MDCG 2019-11 Rev.1.
Gemäß dieser Auslegung würde man zu folgender Einstufung der Risikoklassen kommen:
Änderungsvorschlag der MDR-Regel 11 – Tabelle zur Einstufung der Risikoklassen mit wörtlicher Auslegung
Diese Auslegung ist sehr wahrscheinlich, denn sie würde bedeuten, dass die EU-Kommission versucht hat, die bereits veröffentlichte Tabelle im MDCG-Dokument in einen Gesetzestext zu übersetzen. Interessanterweise kam unser Team durch unsere eigene Analyse der vorgeschlagenen Regel-11-Änderung zu exakt der Tabelle im MDCG-Dokument, ohne sich an dieser zu orientieren.
Wie Sie sehen, fehlt aber auch hier die Risikoklasse I in der Zuordnung. Man müsste daher schon sehr kreativ mit der Argumentation werden, um noch Wege für Software nach Risikoklasse I zu finden.
4. Was fällt noch in Risikoklasse I mit dem Draft für Änderungen der MDR?
Die vorgeschlagene Änderung ist insbesondere für Hersteller von Produkten der Klasse I relevant, die Produkte herstellen, die nur zur Anwendung durch Patienten (medizinische Laien) bestimmt sind. Dazu gehören viele digitale Gesundheitsanwendungen (DiGA) und andere Digital Therapeutics (DTx).
Das aktuell populärste Argument dieser Hersteller zielt auf einen besonderen Wortlaut in der aktuellen MDR ab: „Software, die dazu bestimmt ist, Informationen zu liefern, die zu Entscheidungen für diagnostische oder therapeutische Zwecke herangezogen werden, gehört zur Klasse IIa, […] Sämtliche andere Software wird der Klasse I zugeordnet.“ – Hersteller argumentieren hier, dass ein Patient als medizinischer Laie keine diagnostischen oder therapeutischen Entscheidungen treffen kann. Mehr dazu lesen Sie in unserem Artikel: Klasse I Software nach MDR – Geht das noch?
In der geänderten Regel 11 gibt es diesen Wortlaut aber nicht mehr, wodurch die Rechtfertigung für Risikoklasse I für viele Hersteller nicht mehr ganz einfach werden könnte. Im Gegenteil, durch die Nutzung der Begriffe der MDCG im Gesetzestext (z.B. „Situation or patient condition“ und „Significance of information“) könnten auch deren Definitionen der IMDRF mehr Relevanz bekommen. Dort werden Laien als Nutzer des Medizinprodukts explizit in der Definition einer non-serious oder serious situation inkludiert. Somit würden auch Anwendungen für Laien mindestens in Klasse IIa fallen.
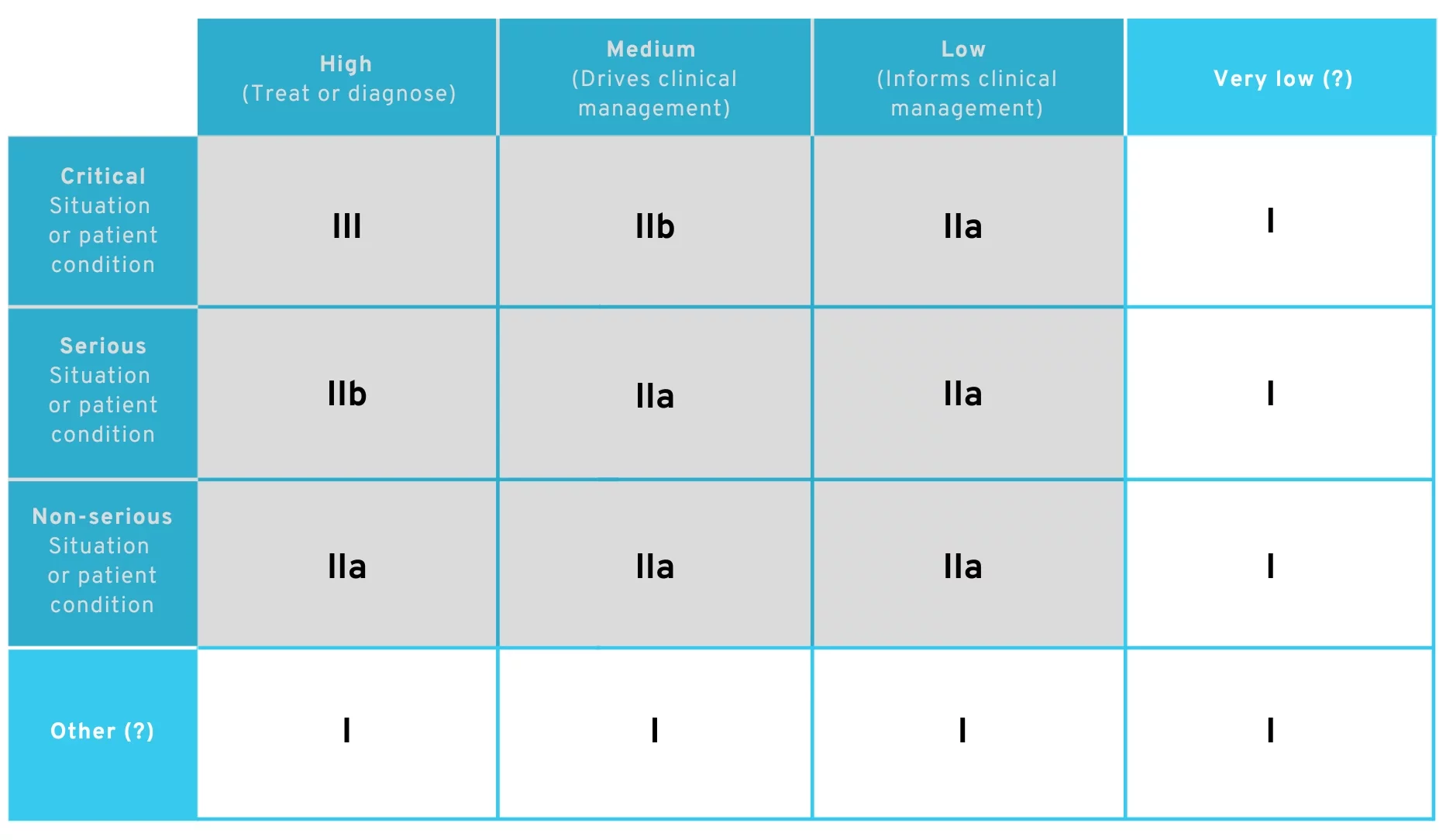
Für uns wäre es denkbar, dass sich dadurch die Diskussion um Begrifflichkeiten verschiebt zu
- Was bedeutet „Clinical Management“?
- Was ist eine Situation, die weder „critical“, „serious“, noch „non-serious“ ist?
Wenn Sie einen Prüfer in Zukunft von der Einordnung in Klasse I überzeugen möchten, müssten Sie daher entweder argumentieren, dass
- die Signifikanz der von der App gelieferten Information nicht einmal „low“ ist oder
- der Zustand des Patienten nicht einmal „non-serious“ ist.
Sie würden durch diese Argumentation quasi die existierende Tabelle um eine Spalte und Reihe erweitern:
Änderungsvorschlag der MDR-Regel 11 – Mögliche Wege in Klasse I
Es ist gut argumentierbar, dass Primärpräventionsanwendungen weiterhin in Klasse I fallen. Für jegliche therapiebegleitende App wird das Eis aber dünn und es ist nicht offensichtlich, wie hierfür noch eine Klasse-I-Argumentation erreicht werden kann.
Zumindest dann, wenn der Entwurf der MDR-Änderung wirklich so umgesetzt wird. Das ist aber alles andere als sicher und Adaptionen sind zu erwarten. Das bringt uns zu unserem nächsten Punkt:
5. Ist dieser Änderungsvorschlag final und wird er so umgesetzt?
Nein. Der vorgeschlagene Wortlaut der neuen Regel 11 ist aktuell lediglich ein Entwurf. Es handelt sich um eine frühe Version im europäischen Gesetzgebungsverfahren. Erfahrungsgemäß werden solche Entwürfe im weiteren Verlauf fachlich und politisch überarbeitet. Gerade bei komplexen Themen wie Software-Klassifizierung sind Änderungen sehr wahrscheinlich. Wir gehen daher aktuell nicht davon aus, dass die Regel 11 in dieser Form unverändert in den finalen Gesetzestext übernommen wird.
6. Zeitplan: Ab wann gelten die MDR-Änderungen und die neue Regel 11?
An dieser Stelle ist zu betonen, dass eine Änderung einer EU-Verordnung meist mehrere Jahre dauert. Daher rechnen wir frühestens im Jahr 2027 mit einer gültigen Revision der MDR (Stand Januar 2026). Auch dies ist eher optimistisch und der Prozess dauert ggf. noch länger.
Jedes Proposal für eine Änderung einer EU-Verordnung wird vor Verabschiedung einem mehrstufigen Prozess unterzogen:
- Gesetzgebungsvorschlag (Legislative Proposal): Die Europäische Kommission erarbeitet einen formellen Verordnungsentwurf und legt diesen dem Europäischen Parlament und dem Rat der EU zur Prüfung vor.
- Erste Lesung (First Reading): Das Europäische Parlament und der Rat befassen sich erstmals mit dem Vorschlag, können Änderungsanträge einbringen und versuchen, eine gemeinsame Position zu finden.
- Zweite Lesung (Second Reading): Kommt es in der ersten Lesung zu keiner Einigung, folgt eine zweite Prüfung durch Parlament und Rat, bei der weitere Änderungen möglich sind oder der Vorschlag abgelehnt werden kann.
- Vermittlungsverfahren (Conciliation): Können sich Parlament und Rat weiterhin nicht einigen, wird ein Vermittlungsausschuss eingesetzt, der innerhalb einer festen Frist einen gemeinsamen Kompromisstext ausarbeitet.
- Dritte Lesung (Third Reading): Der im Vermittlungsverfahren ausgehandelte Text wird abschließend sowohl vom Europäischen Parlament als auch vom Rat angenommen oder verworfen. Erst danach kann die Verordnung in Kraft treten.
Der gesamte Prozess wird hier im Detail beschrieben.
Wir beobachten die weiteren Entwicklungen eng und aktualisieren diesen Artikel laufend. Über relevante Änderungen informieren wir in unserem Newsletter.
7. Weitere Interpretationen
Es gibt weitere Wege, den vorgeschlagenen Wortlaut der Regel 11 zu interpretieren. Fakt ist aber, dass dieser Wortlaut vermutlich nach entsprechenden Revisionen nicht genau so in der MDR landen wird. Demnach ist eine Auflistung jeder noch so unwahrscheinlichen Interpretationsmöglichkeit zum aktuellen Zeitpunkt bislang nicht zielführend.
8. Fazit
Der Änderungsvorschlag der Regel 11 erscheint uns nach der obigen Auslegung gravierend. Die meisten Software-Medizinprodukte der Klasse I würden mit der neuen Regel sehr klar in Klasse IIa (oder höher) fallen, was für viele Hersteller ein ernst zu nehmendes Problem wäre. Ob das mit Absicht ist, zweifeln wir aktuell stark an. Das würde dem erklärten Ziel der Innovationsförderung komplett widersprechen.
Auch erscheint uns die aktuelle Formulierung der Regel 11 fachlich inkonsistent. Insbesondere fehlt eine klare und nachvollziehbare Abbildung von Software mit sehr niedrigem Risiko, wie sie beispielsweise in der von der IMDRF vorgeschlagenen 3×3-Risikomatrix vorgesehen ist. Dort ist explizit eine Kategorie für geringfügige klinische Auswirkungen vorgesehen, die sachlich einer Klasse-I-Einstufung entsprechen würde. Diese Differenzierung geht im aktuellen Entwurf verloren. Daher gehen wir davon aus, dass dies ein unbeabsichtigter Fehler ist und in den kommenden Änderungen des Entwurfs noch angepasst wird.

Kategorien für Software as a Medical Device (SaMD) von der IMDRF
Generell blicken wir weiterhin hoffnungsvoll in die Zukunft: Der aktuelle Draft existiert nur in einer ersten Version. Bis so eine Änderung einer EU-Verordnung passiert, stehen noch mehrere formale Schritte im europäischen Gesetzgebungsverfahren an.
Erfahrungsgemäß wird der Wortlaut in diesem Prozess weiter angepasst und präzisiert. Dass der aktuelle Entwurf der MDR-Änderung so final in der Verordnung landet, ist unwahrscheinlich.
Wir halten Sie hierzu in unserem Newsletter auf dem neuesten Stand.