Dass ein Herzschrittmacher ein reguliertes Medizinprodukt sein sollte, ist einleuchtend. Bei Software, gerade bei Apps, ist die Unklarheit jedoch größer. Auch Software muss als reguliertes Medizinprodukt nach Medical Device Regulation (MDR) klassifiziert werden, wenn sie für bestimmte Zwecke wie die Diagnose oder Therapie von Krankheiten genutzt wird. Wenn Sie Ihr Produkt als DiGA (digitale Gesundheitsanwendung) in die Erstattung bringen wollen, ist die Klassifizierung als Medizinprodukt sogar eine der Anforderungen.
In diesem Artikel geben wir Ihnen detaillierte Hilfestellungen, damit Sie fundiert entscheiden können, ob Ihre App bzw. Software sich als MDR-Medizinprodukt qualifiziert.
Im Anschluss finden Sie hier einen Leitfaden zur Bestimmung der richtigen Risikoklasse für Ihre Software: Klassifizierung von Software-Medizinprodukten: MDR-Leitfaden.
Update Juni 2025: Das offizielle Guidance-Dokument „MDCG 2019-11: Guidance on Qualification and Classification of Software […]“ wurde überarbeitet und in Revision 1 veröffentlicht. Dieser Artikel spiegelt alle Aktualisierungen wider. Eine genaue Auflistung steht im folgenden Kapitel: Zum Kapitel über Revision 1
Inhaltsverzeichnis
- 1. Terminologie: MDR, Medizinprodukt & CE
- 2. Motivation: Software als Medizinprodukt
- 3. Fokus des Artikels: MDR
- 4. Wann ist meine App/Software offiziell ein Medizinprodukt?
- 5. Die Zweckbestimmung entscheidet
- 6. Was bedeutet dies konkret?
- 7. Typen von Apps/Software als Medizinprodukt
- 8. Häufige Unklarheiten
- 9. Wer entscheidet schlussendlich?
- 10. Medizinprodukt-Zulassung ohne Regulatorik?
- 11. Juni 2025: Update der offiziellen MDCG-Guidance
- 12. Fazit
1. Terminologie: MDR, Medizinprodukt & CE
Im Rahmen dieses Artikels definiert sich der Begriff „Medizinprodukt“ über die Begriffsbestimmung in der Medical Device Regulation (MDR). Knapp zusammengefasst: Ein Medizinprodukt ist ein Produkt mit medizinischer Zweckbestimmung. Damit Medizinprodukte auf dem europäischen Markt in den Verkehr gebracht oder in Betrieb genommen werden können, müssen sie mit einer CE-Kennzeichnung versehen werden.
Eine Software als Medizinprodukt wird offiziell auch Medical Device Software (MDSW) genannt. Die Feststellung, ob eine Software unter die Definition eines Medizinprodukts fällt, wird als Qualifizierung bezeichnet.
Den gesamten Weg zur Medizinproduktzulassung (und somit zur CE-Kennzeichnung) beleuchten wir in diesem Artikel: Zulassung & Zertifizierung von Software-Medizinprodukten (MDR)
2. Motivation: Software als Medizinprodukt
Meist beginnt alles mit der Idee, eine App oder Software zu entwickeln, die im Gesundheits-/Medizinbereich Anwendung finden soll. Im zweiten Schritt stellt sich nun die Frage, ob Ihr geplantes Produkt ein Medizinprodukt ist oder nicht. Wir sind als Software-Dienstleister auf die Entwicklung von Medical Software spezialisiert und kennen die Problematik daher sehr gut. Diese Evaluation hat einen großen Einfluss auf die Zukunft Ihres Produkts. Je nachdem, ob Sie Ihre App als Medizinprodukt auf den Markt bringen, ändern sich viele Gegebenheiten.
Auf der Contra-Seite: eine App als Medizinprodukt…
- ist aufwändiger und damit kostenintensiver
- benötigt Fachwissen im Bereich Qualitätsmanagement, das man entweder intern aufbauen muss oder extern einkauft
Auf der Pro-Seite: eine App als Medizinprodukt…
- lässt sich ggf. (einfacher) von den Krankenversicherungen erstatten. Eine Klassifizierung als Medizinprodukt ist z.B. Grundvoraussetzung, um in das DiGA-Verzeichnis aufgenommen zu werden.
- hebt die eigene Anwendung von der Konkurrenz ab, die ggf. nicht als Medizinprodukt zugelassen wurde. Das CE-Kennzeichen schafft Vertrauen bei Patienten, Ärzten, Krankenkassen und sonstigen Healthcare-Professionals.
Die Entscheidung, ob die eigene App ein Medizinprodukt ist, liegt allerdings nur indirekt bei Ihnen. Ein gegebenes Produkt mit festgelegter Zweckbestimmung und Funktionalität fällt entweder unter die Definition eines Medizinprodukts oder nicht. Das hängt vom MDR-Gesetzestext ab. Daran müssen Sie sich also halten. Ansonsten handeln Sie nicht legal (dazu weiter unten mehr).
Um die Klassifizierung als Medizinprodukt zu vermeiden, können Sie aber natürlich die Zweckbestimmung, Funktionalität und Vermarktung des Produkts entsprechend verändern. Wenn Sie zum Beispiel erst vorhatten, eine App für die Unterstützung der Therapie von Reha-Patienten zu entwickeln, können Sie stattdessen eine Fitness-App entwickeln (die nicht speziell Patienten als Zielgruppe hat und bei der Therapie nicht Teil der Zweckbestimmung ist). Lesen Sie mehr in unserem Artikel zur Formulierung der Zweckbestimmung.
3. Fokus des Artikels: MDR
Wir konzentrieren uns in diesem Rahmen auf den europäischen Markt, und betrachten speziell die Medical Device Regulation (MDR). Da eine Zertifizierung als Medizinprodukt nach Medical Device Directive (MDD) seit dem 26.05.2021 nicht mehr möglich ist, gehen wir hier nicht weiter auf diese ein. Bei der Definition eines Medizinprodukts gibt es im Übrigen weitreichende Überschneidungen zwischen MDR und MDD.
Außerdem betrachten wir in diesem Artikel speziell eigenständige Software (auch Standalone Software genannt) als Medizinprodukt. Dazu zählen insbesondere auch mobile Apps. Wir gehen nicht weiter auf Hardware (wie Herzschrittmacher) ein.
4. Wann ist meine App/Software offiziell ein Medizinprodukt?
Bevor wir uns konkrete Beispiele ansehen, ist es wichtig zu verstehen, was „offiziell“ darüber entscheidet, ob Ihre App ein Medizinprodukt ist. Überraschenderweise hängt dies nur von einer einzigen Definition in der MDR ab. Ihre App ist ein Medizinprodukt, wenn diese unter die Definition („Begriffsbestimmung“) der MDR eines Medizinprodukts fällt:
„Medizinprodukt“ bezeichnet ein Instrument, einen Apparat, ein Gerät, eine Software, ein Implantat, ein Reagenz, ein Material oder einen anderen Gegenstand, das dem Hersteller zufolge für Menschen bestimmt ist und allein oder in Kombination einen oder mehrere der folgenden spezifischen medizinischen Zwecke erfüllen soll:
- Diagnose, Verhütung, Überwachung, Vorhersage, Prognose, Behandlung oder Linderung von Krankheiten,
- Diagnose, Überwachung, Behandlung, Linderung von oder Kompensierung von Verletzungen oder Behinderungen,
- Untersuchung, Ersatz oder Veränderung der Anatomie oder eines physiologischen oder pathologischen Vorgangs oder Zustands,
- Gewinnung von Informationen durch die In-vitro-Untersuchung von aus dem menschlichen Körper — auch aus Organ-, Blut- und Gewebespenden — stammenden Proben
und dessen bestimmungsgemäße Hauptwirkung im oder am menschlichen Körper weder durch pharmakologische oder immunologische Mittel noch metabolisch erreicht wird, dessen Wirkungsweise aber durch solche Mittel unterstützt werden kann.Die folgenden Produkte gelten ebenfalls als Medizinprodukte:
- Produkte zur Empfängnisverhütung oder -förderung,
- Produkte, die speziell für die Reinigung, Desinfektion oder Sterilisation der in Artikel 1 Absatz 4 genannten Produkte und der in Absatz 1 dieses Spiegelstrichs genannten Produkte bestimmt sind.
5. Die Zweckbestimmung entscheidet
Konkret bedeutet dieser Paragraph u. a., dass für die Qualifizierung (die Entscheidung, ob Ihr Produkt ein Medizinprodukt ist), die Zweckbestimmung Ihres Produkts ausschlaggebend ist. Die Liste an Funktionen Ihrer App/Software ist nicht relevant bzw. hat nur indirekt Einfluss auf die Zweckbestimmung. Falls die Zweckbestimmung Ihrer App z. B. die Therapie, Diagnose oder Prävention von Krankheiten ist, muss sie als Medizinprodukt nach MDR klassifiziert werden und ist damit sogenannte Medical Device Software (MDSW). Der Begriff der „Zweckbestimmung“ wird von der MDR folgendermaßen definiert:
„Zweckbestimmung“ bezeichnet die Verwendung, für die ein Produkt entsprechend den Angaben des Herstellers auf der Kennzeichnung, in der Gebrauchsanweisung oder dem Werbe- oder Verkaufsmaterial bzw. den Werbe- oder Verkaufsangaben und seinen Angaben bei der klinischen Bewertung bestimmt ist;
Hier wird auch deutlich, dass die definierte Zweckbestimmung Ihres Produkts auch z. B. auf allen Marketing-/Verkaufs-Kanälen so kommuniziert werden muss. Sie können Ihr Medizinprodukt nicht unter einer anderen Zweckbestimmung vermarkten als Sie in der Konformitätserklärung angegeben haben.
Wenn Sie Hilfe bei der Formulierung der Zweckbestimmung brauchen, finden Sie in diesem Artikel weitere Informationen: Formulierung der Zweckbestimmung für (Software-)Medizinprodukte
Nehmen wir hierfür mal das Beispiel einer Diabetes-App. Falls Ihre Software die Zweckbestimmung „der Dokumentation von Glukosewerten“ hat, ist sie kein Medizinprodukt. Sie dient nicht der Therapie, Prävention, Diagnose usw. von Krankheiten. Sie ist ein reines Dokumentationstool ohne direkten medizinischen Zweck. Falls Ihre Anwendung jedoch die dokumentierten Werte auswertet und auf dieser Basis Ratschläge gibt („Sie sollten etwas essen“), liegen „Therapie-Empfehlungen“ vor. Die App hat somit z. B. den Zweck „der Therapie von Diabetes“. Sie ist ein Medizinprodukt.
Dass die Zweckbestimmung im Vordergrund steht, wird auch im Vorwort (19) der MDR nochmal verdeutlicht:
Es muss eindeutig festgelegt werden, dass Software als solche, wenn sie vom Hersteller speziell für einen oder mehrere der in der Definition von Medizinprodukten genannten medizinischen Zwecke bestimmt ist, als Medizinprodukt gilt, während Software für allgemeine Zwecke, auch wenn sie in Einrichtungen des Gesundheitswesens eingesetzt wird, sowie Software, die für Zwecke in den Bereichen Lebensstil und Wohlbefinden eingesetzt wird, kein Medizinprodukt ist. […]
Software/Apps für allgemeine Zwecke, und damit nicht die konkrete Anwendung im medizinischen Bereich, sind kein Medizinprodukt. Beispielsweise ist Microsoft Excel kein Medizinprodukt, weil es für Anwendungsfälle jeglicher Art bestimmt ist. Auch mit Excel lassen sich natürlich bestimmte Kennzahlen berechnen, die für die z.B. für die Diagnose einer Krankheit verwendet werden könnten. Dies ist jedoch nicht die Zweckbestimmung von Excel. Eine App/Software, die speziell die Berechnung von Kennzahlen zur Diagnose einer bestimmten Krankheit als Zweck hat, ist hingegen ein Medizinprodukt.
Hinweis: Es ist möglich, dass Ihre Software/App nicht unter die MDR, sondern die IVDR (In-vitro Diagnostics Regulation) fällt. Falls Ihre App für die Gewinnung von Informationen durch die In-vitro-Untersuchung von aus dem menschlichen Körper stammenden Proben bestimmt ist, fällt sie unter die IVDR. Die Qualifikations-Kriterien sind ähnlich. Weitere Informationen zur IVDR-Softwareklassifizierung finden Sie in unserem Leitfaden: IVDR Software: Qualifizierung und Klassifizierung
6. Was bedeutet dies konkret?
Wie man oben sieht entscheidet ein einziger Artikel der MDR, welche Software oder Geräte ein Medizinprodukt sind. Sie müssen für diese Entscheidung also nicht die komplette MDR durchwälzen. Das scheint auf den ersten Blick ein Vorteil zu sein. Das ist jedoch leider eher ein Nachteil: die Begriffsbestimmung ist sehr knapp und damit sehr vage. Um in konkreten Fällen zu entscheiden, braucht es etwas mehr Hintergrundwissen und Guidance.
Daher gibt es Dokumente, die mit konkreten Beispielen versuchen den Sachverhalt besser zu erklären. Das wohl wichtigste Guidance-Dokument im Rahmen der MDR stammt von der MDCG (Medical Device Coordination Group) und trägt den Titel „MDCG 2019-11 Qualification and classification of software […]“. Innerhalb dieses Artikels beziehen wir uns auf dieses Dokument mit „MDCG Guidance“ (obwohl es eine Vielzahl an unterschiedlichen Guidance Dokumenten der MDCG gibt).
Die MDCG Guidance ist nicht rechtlich bindend, hilft aber bei der Interpretation des MDR-Paragraphen. Was wir in diesem Artikel mit Software als Medizinprodukt benennen, bezeichnet die MDCG Guidance als Medical Device Software (MDSW). Um die Entscheidung zu erleichtern, ob Ihre Anwendung eine MDSW ist (und damit ein Medizinprodukt), enthält die MDCG Guidance u.a. einen Entscheidungsbaum:
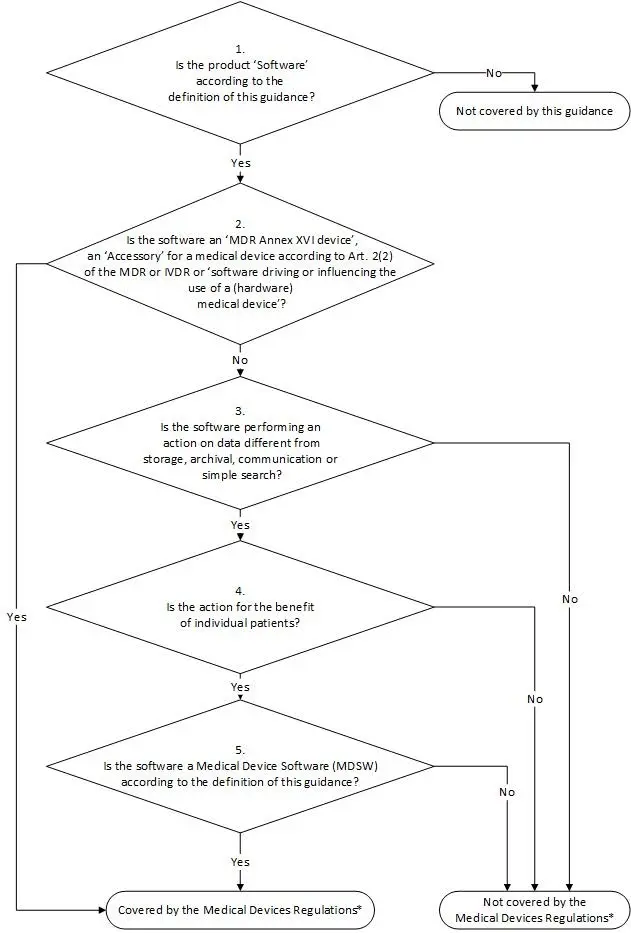
Entscheidungsbaum der MDCG Guidance: Zum Vergrößern klicken
7. Typen von Apps/Software als Medizinprodukt
Innerhalb der MDR und MDCG Guidance lässt sich zwischen drei verschiedenen Typen von Software/Apps als Medizinprodukt (bzw. MDSW) unterscheiden:
1. Zubehör eines Medizinprodukts
Falls Ihre Software/App ein anderes Medizinprodukt (meist Hardware) steuert oder beeinflusst, handelt es sich womöglich um Zubehör eines Medizinprodukts. Die MDR definiert dies folgendermaßen:
„Zubehör eines Medizinprodukts“ bezeichnet einen Gegenstand, der zwar an sich kein Medizinprodukt ist, aber vom Hersteller dazu bestimmt ist, zusammen mit einem oder mehreren bestimmten Medizinprodukten verwendet zu werden, und der speziell dessen/deren Verwendung gemäß seiner/ihrer Zweckbestimmung(en) ermöglicht […]
Die steuernde Software ist damit selbst auch ein Medizinprodukt.
2. Eigenständiges Medizinprodukt
Falls Ihre Software/App unabhängig eine eigene medizinische Zweckbestimmung hat, handelt es sich um ein eigenständiges Medizinprodukt. Eine App, die auf Basis bestimmter Eingabewerte Therapieempfehlungen gibt, ist z.B. ein eigenständiges Medizinprodukt. Der Großteil der DiGA wird z.B. in diese Kategorie fallen.
3. Teil eines Medizinprodukts
Bestimmte Software ist integraler Teil des Medizinprodukts. Die Software muss daher nicht eigenständig neu klassifiziert werden. Dazu zählt vor allem Embedded Software, wie z.B. die Software/Firmware eines Blutdruck-Messgeräts. Eine App wird kaum in diese Kategorie fallen, weil sie auf einem Smartphone läuft, welches selbst kein Medizinprodukt ist.
Je nach Typ gelten im Rahmen der MDR leicht abweichende Regelungen, auf die wir hier nicht näher eingehen werden.
8. Häufige Unklarheiten
Bei der Auswertung, ob ein Medizinprodukt vorliegt, gibt es einige typische Unklarheiten. Einen Teil davon lösen wir hier auf:
Kommunikation & Datenspeicherung:
Ein Chat oder eine Video-Call Lösung ist in der Regel kein Medizinprodukt. Der Zweck ist die reine Kommunikation. Dies gilt z.B. auch für reine Datenspeicherung/Dokumentation. Die MDCG Guidance schreibt hierzu ganz klar: „Storage, archival, communication & simple search is not medical product“.
Einfluss des Betriebssystems, der Laufzeitumgebung und „Aufenthaltsort“ der Software:
Ob Ihre Software auf einem entfernten Server läuft, ob Sie auf dem Smartphone läuft, ob sie auf Android oder Windows läuft, hat alles keinen Einfluss auf die Entscheidung, ob es ein Medizinprodukt ist. Wie oben beschrieben: die Zweckbestimmung zählt.
Mögliches Patientenrisiko:
Mit welchem Risiko Ihre App/Software einem Patienten Schaden zufügt, ist nicht relevant. Die Wahrscheinlichkeit und Schweregrad eines möglichen medizinischen Schadens haben keinen Einfluss darauf, ob Ihre App ein Medizinprodukt ist. Folgende Argumentation ist nicht zielführend: „Unsere App kann doch nur einen sehr geringen Schaden verursachen. Daher sollte es kein Medizinprodukt sein.“ Wenn der Zweck z.B. dennoch die Therapie einer Krankheit ist, reden wir weiter von einem Medizinprodukt.
Indirekter vs. direkter Schaden:
Oft wird angenommen, dass bestimmte Apps kein Medizinprodukt sind, weil sie „nur eine Entscheidungsunterstützung“ für den Arzt oder Patient darstellen. Am Ende entscheidet immer noch der Arzt bzw. Patient, wie gehandelt wird. Daher sollte es kein Medizinprodukt sein? Auch diese Argumentation ist nicht zielführend. Wenn Ihre App Therapieempfehlungen gibt, ist der medizinische Zweck die „Therapie einer Krankheit“ und damit ein Medizinprodukt. Und das ist auch richtig so: Ein überarbeiteter Arzt oder müder Patient vertraut tendenziell mehr und mehr seinem Software-Tool. Bestimmte Empfehlungen werden evtl. nicht mehr hinterfragt, und damit könnten potentiell falsche Entscheidungen mit schwerwiegenden Konsequenzen getroffen werden. Insofern sie für die Therapie von Diabetes bestimmt sind, sind also folgende Produkte damit gleichermaßen Medizinprodukte: eine physische Insulinpumpe, eine App zur Kontrolle einer Insulinpumpe, oder auch nur eine App, die konkrete Dosis-Empfehlungen für das Injizieren von Insulin gibt.
Nutzer der Software: Patient, Arzt oder ein „Laie“:
Nur weil Ihre App nicht von einem Arzt oder Patient benutzt wird, heißt es nicht, dass es kein Medizinprodukt ist. Eine Mutter könnte beispielweise Ihrem Kind mit eingeschränkter Mobilität bei der Therapie einer Krankheit helfen. Dafür verwendet die Mutter womöglich eine Software. Sie hat jedoch keine medizinische Ausbildung und ist nicht selbst ein Patient. Trotzdem ist der Zweck die Therapie. Damit besteht ein Risiko, dass die Therapie falsch durchgeführt, und damit ist die Anwendung auch moralisch gesehen zu Recht ein Medizinprodukt.
Vergleich mit anderen Apps am Markt
Gerne wird auch versucht über den Vergleich mit anderen Apps am Markt zu argumentieren: „App XY ist im App Store, hat die gleiche Funktionalität wie unsere App und ist kein Medizinprodukt. Wieso müssen wir dann ein Medizinprodukt sein?“
Auch der Vergleich mit anderen Apps hilft hier nicht weiter. Es gibt viele Apps am Markt, die wohl eigentlich als Medizinprodukt klassifiziert sein sollten, dies aber nicht sind. Daraus lassen sich jedoch keinerlei Schlüsse für die eigene App ziehen. Oft haben die Hersteller derartiger Apps aus reiner Unwissenheit agiert. Im Falle einer Klage/Mahnung, sind diese jedoch angreifbar. Wenn Sie ein stabiles Geschäft mit Ihrer App aufbauen wollen, sollten Sie sich an die Gesetzgebung halten.
9. Wer entscheidet schlussendlich?
Sie müssen selbst entscheiden, ob Ihre Software ein Medizinprodukt ist. Dazu können Sie das BfArM, Berater, Anwälte oder auch benannte Stellen hinzuziehen. Am Ende liegt die Entscheidung jedoch weiterhin bei Ihnen. Im Falle einer Klage, wird Ihre Entscheidung vom Gericht überprüft.
Falls Sie Ihre Software z. B. fälschlicherweise nicht als Medizinprodukt auf den Markt gebracht haben, tragen Sie die Konsequenzen. Die Überprüfung durch einen Richter, kann z. B. durch einen Schadensfall ausgelöst werden. Ein Patient oder die Konkurrenz könnte sie verklagen bzw. eine Abmahnung schicken.
Wenn Sie also unsicher sind, lohnt es sich, eine Einschätzung oder ein Gutachten von einer dritten Partei einzuholen. Folgende Möglichkeiten stehen Ihnen hierfür zur Verfügung:
- beim BfArM anfragen (die langen Antwortzeiten sind hier jedoch meist nicht ausreichend)
- ein Gutachten von einem spezialisierten Anwalt in diesem Bereich ausstellen lassen
- eine Einschätzung oder ein Gutachten von einem Regulatory-Berater einholen
Es ist nochmal wichtig zu betonen, dass auch diese Einschätzungen und Gutachten Sie nicht automatisch rechtlich schützen. Bei einer Klage, müsste Sie z. B. ein Anwalt immer noch vor Gericht auf Basis dieses Gutachtens verteidigen. Die Chance ist jedoch hoch, dass Sie den Prozess gewinnen, wenn Ihr Anwalt sorgfältige Arbeit geleistet hat.
10. Medizinprodukt-Zulassung ohne Regulatorik?
Gibt es einen Weg, die regulatorischen Pflichten für Medizinprodukt-Hersteller komplett zu vermeiden?
Ja, den gibt es: die Auslagerung der sogenannten Legalhersteller-Rolle an ein externes Unternehmen. Dies ist eine effiziente und risikominimierende Lösung, um Ihre Ressourcen zu schonen und gleichzeitig regulatorische Sicherheit zu schaffen. Sie müssen kein Qualitätsmanagement-System aufbauen und können den regulatorischen Zulassungsprozess vollständig abgeben.
So können Sie sich auf die Produktkonzeption und Vermarktung konzentrieren, während QuickBird Medical als Legalhersteller alle regulatorischen Anforderungen übernimmt und für die Einhaltung haftet.
Mehr Informationen dazu finden Sie hier: Zum Fachartikel
11. Juni 2025: Update der offiziellen MDCG-Guidance
Im Juni 2025 wurde ein in der Digital-Health-Szene lange erwartetes Update des offiziellen MDCG-Guidance-Dokuments zur Risikoklassifizierung und Qualifizierung durchgeführt.
Alle Änderungen wurden bereits in diesem Artikel berücksichtigt. Insgesamt hat sich in Bezug auf die Qualifizierung von Medical Device Software (MDSW) bzw. Medizinprodukt-Software nichts Grundlegendes geändert.
Die wichtigsten Änderungen waren die folgenden:
- Es wird mit mehr Details auf die Formulierung der Zweckbestimmung für MDSW eingegangen.
- Konkretisierung, dass die Kalkulation und Interpretation von medizinischen Informationen zu einer medizinischen Zweckbestimmung und Einstufung als Medizinprodukt führen könnte.
- Konkretisierung, dass Fitness- und Wellness-Apps keine Medizinprodukte darstellen.
- Neue Informationen bezüglich der Anwendbarkeit der European Health Data Space Regulation (EHDS)
- Eine breite Palette an anschaulichen Beispielen, die sich als Medizinprodukt oder Nicht-Medizinprodukt qualifizieren.
Die neue Version der MDCG-Guidance finden Sie hier.
12. Fazit
Es ist nicht immer einfach zu entscheiden, ob Ihre App/Software ein Medizinprodukt ist. Die Definition der MDR gibt nur sehr vage Vorgaben. Die MDCG-Guidance versucht mit anschaulichen Beispielen, ein besseres Verständnis zu vermitteln. Im Zweifelsfall ist es jedoch immer ratsam, nach einer dritten Meinung zu fragen. Falls Sie zusätzlich noch wissen möchten, ob Ihre App sich nicht nur als Medizinprodukt qualifiziert, sondern auch, in welche Risikoklasse diese fällt, lohnt sich ein Blick in unseren Artikel „Klassifizierung von Software-Medizinprodukten: MDR-Leitfaden“.
Wir entwickeln Medical Apps und Medical Software auf Auftragsbasis für unsere Kunden. Daher sehen wir uns regelmäßig mit der behandelten Fragestellung konfrontiert. Für eine kostenlose Ersteinschätzung, ob Ihre App/Software ein Medizinprodukt ist, kontaktieren Sie uns jederzeit gerne.





