Die Medical Device Regulation (MDR) bringt viele Herausforderungen für Hersteller von Software-Medizinprodukten mit sich. Neben dem Aufbau eines Qualitätsmanagementsystems (QMS) und der Erstellung der technischen Dokumentation kommen regulatorische Haftungsrisiken auf Hersteller zu.
Für viele Unternehmen stellt sich daher die Frage:
Gibt es einen Weg, die regulatorischen Pflichten für Medizinprodukt-Hersteller komplett an einen Dienstleister auszulagern?
Ja, den gibt es: Die Auslagerung der sogenannten Legalhersteller-Rolle an ein externes Unternehmen. Dies ist eine effiziente und risikominimierende Lösung, um Ihre Ressourcen zu schonen und gleichzeitig regulatorische Sicherheit zu schaffen.
In diesem Leitfaden …
- … beleuchten wir die Vorteile eines externen Legalherstellers für Ihr Produkt,
- … beantworten wir die wichtigsten Fragen rund um diesen Ansatz und
- … sehen uns an, für welche Unternehmen dieses Modell wirklich Sinn ergibt.
Inhaltsverzeichnis
- 1. Problem: Pflichten für Legalhersteller von Medizinprodukten
- 2. Lösung: Externer Inverkehrbringer für MDR-Medizinprodukte
- 3. Vorteile eines externen Herstellers nach MDR
- 4. Ablauf einer solchen Zusammenarbeit zur Auslagerung der Legalhersteller-Rolle
- 5. Wichtige Fragen und Antworten
- 5.1. Ich möchte die Hersteller-Rolle auslagern, um das Produkt schneller auf den Markt zu bringen. Später möchte ich die Hersteller-Rolle für das Produkt aber wieder selbst übernehmen. Ist das möglich?
- 5.2. Behalte ich alle Besitzrechte am Produkt?
- 5.3. Ist das teurer als die Themen inhouse zu übernehmen?
- 5.4. Wer haftet für das Produkt im regulatorischen Sinne, z.B. bei Patientenschäden?
- 5.5. Kann die Hersteller-Rolle für eine DiGA ausgelagert werden?
- 5.6. Kann ich meine Hersteller-Rolle für ein zertifiziertes Medizinprodukt nachträglich auslagern?
- 5.7. Kann ich das Produkt nach Inverkehrbringen weiterentwickeln?
- 5.8. Kann ich weiterhin ein eigenes Entwicklerteam nutzen?
- 6. Beispiele für Medizinprodukte-Hersteller mit externem Inverkehrbringer
- 7. Fazit: Für wen lohnt es sich, die Hersteller-Rolle auszulagern?
1. Problem: Pflichten für Legalhersteller von Medizinprodukten
Wenn Sie eine Software entwickeln möchten, die als Medizinprodukt zertifiziert werden soll, kommen erhebliche Aufwände auf Sie zu. Der Hersteller eines Software-Medizinprodukts muss nach MDR u.a. folgende Pflichten erfüllen:
- Aufbau eines Qualitätsmanagementsystems (QMS): Aufbau der Prozesse und Strukturen (nach MDR & ISO 13485)
- Erstellung der technischen Dokumentation: Einhaltung der MDR, IEC 62304, IEC 62366-1, ISO 13485, IEC 82304, ISO 14971 (um hier nur die wichtigsten Normen und Gesetze zu nennen)
- Haftung für das Produktrisiko im Rahmen der MDR: Sie haften als Hersteller bei Patientenschäden oder Konformitätsverletzungen Ihrer regulatorischen Pflichten. Bei fahrlässigem Handel haften Sie ggf. sogar persönlich im Sinne des Strafrechts.
- Kontinuierliche Durchführung aller Qualitätsmanagementprozesse: Post-Market-Surveillance (PMS), Post-Market-Clinical-Follow-Up (PMCF), Vigilanz, Management Reviews, interne Audits, Schulungen, Computerized Systems Validation (CSV), Risikomanagement, klinische Bewertung usw.
- Überwachung der Informationssicherheit: Sie müssen die Informationssicherheit Ihres Produkts und Ihrer Firma durch strukturierte Prozesse und Maßnahmen im Griff haben.
Wenn Sie noch nie ein Medizinprodukt nach MDR in Verkehr gebracht haben, kommen damit erhebliche Aufwände und Pflichten auf Sie zu.
2. Lösung: Externer Inverkehrbringer für MDR-Medizinprodukte
Wenn Sie die oben genannten Pflichten nicht erfüllen möchten oder können, gibt es eine sinnvolle Alternative: die Rolle des Herstellers nach MDR an einen Dienstleister auszulagern.
So können Sie sich auf Ihre Kernkompetenzen konzentrieren, während der Dienstleister die volle Verantwortung für das regulatorische Inverkehrbringen Ihres Software-Medizinprodukts im Rahmen der MDR übernimmt.
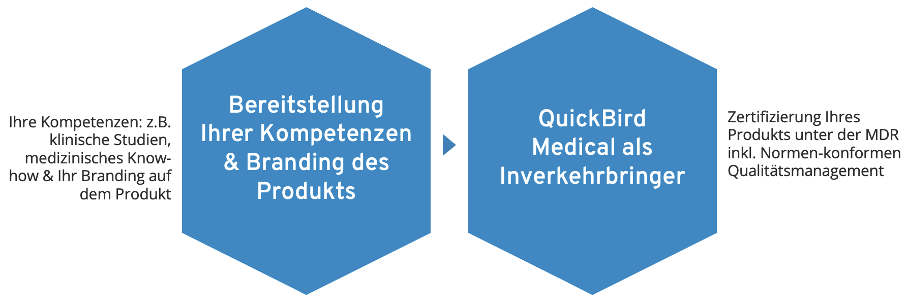
QuickBird Medical als externer Inverkehrbringer für Ihr Software-Produkt
Hinweis: Im Rahmen dieses Artikels werden die Begriffe „Legalhersteller“, „Hersteller“ und „Inverkehrbringer“ synonym verwendet.
2.1. Händler und Hersteller für Ihr Software-Medizinprodukt
Je nach Verantwortlichkeitsverteilung ergeben sich unterschiedliche regulatorische Rollen. Eine übliche Rollenverteilung ist es, dass wir bei QuickBird Medical die Rolle des sogenannten Legalherstellers nach MDR übernehmen und Sie die Rolle des sogenannten Händlers übernehmen.
Dementsprechend haftet QuickBird Medical für alle Pflichten, die sich nach MDR auf den Medizinprodukt-Hersteller beziehen.
Sie können dann ihr eigenes Logo/Design/Branding auf dem Produkt platzieren, aber die regulatorischen Aufwände erfolgreich auslagern.
Als Händler übernehmen Sie ggf. dann den Kunden-Support, Vertrieb und Marketing des Produkts. Auch hier gibt es z.B. im Rahmen des Heilmittelwerbegesetzes einige Pflichten, die Sie beachten müssen. Wir schulen Sie in diesen Themen und unterstützen Sie. So reduziert sich Ihr Aufwand in Bezug auf regulatorische Themen auf das absolute Minimum.
2.2. OEM und PLM für Ihr Software-Medizinprodukt
Im Rahmen der früher geltenden Medical Device Directive (MDD) war die sogenannte OEM-PLM-Konstellation gängig:
- OEM (Original Equipment Manufacturer): Der OEM ist der tatsächliche Entwickler und Produzent des Software-Medizinprodukts. Er erstellt die vollständige technische Dokumentation, führt alle notwendigen Konformitätsbewertungsverfahren durch und bringt das Produkt zunächst gesetzeskonform zur Marktreife. Der OEM trägt somit die regulatorische Verantwortung für die Produktsicherheit und -konformität.
- PLM (Private Label Manufacturer): Der PLM übernimmt das fertige Medizinprodukt vom OEM und bringt es unter eigenem Namen, Logo und Branding auf den Markt.
Nach Ablösung der MDD durch die MDR gibt es die OEM-PLM-Konstellation in ihrer ursprünglichen Form nicht mehr. Stattdessen spricht man von einer Händler-Hersteller-Konstellation als Alternative, welche in den vorangegangenen Kapiteln beschrieben wird. So lassen sich dieselben Ziele weiterhin auch unter MDR erreichen.
3. Vorteile eines externen Herstellers nach MDR
Die Auslagerung der Hersteller-Rolle an einen externen Legalhersteller bietet u.a. folgende Vorteile:
- Schneller und einfacher Marktzugang: Ein externer Hersteller ermöglicht es, Produkte deutlich schneller auf den Markt zu bringen, da er über bestehende Zertifizierungen (z. B. ISO 13485) und erprobte Qualitätsmanagementprozesse verfügt. Dies spart Zeit und vermeidet Verzögerungen durch aufwendige interne Vorbereitungen.
- Entlastung von Ressourcen und Kosten: Die regulatorischen Pflichten werden vollständig ausgelagert, wodurch Unternehmen interne Ressourcen wie Personal und finanzielle Mittel für andere Projekte freisetzen können. Die hohen Kosten für die Einrichtung und Pflege eines QMS, Zertifizierungen sowie Audits entfallen oder werden erheblich reduziert.
- Regulatorische Sicherheit und Risikominimierung: Der externe Hersteller bringt umfassende regulatorische Expertise mit und sorgt dafür, dass Produkte den neuesten regulatorischen Anforderungen entsprechen. Auch das Risiko von Haftung bei Produktrückrufen oder Sicherheitsvorfällen wird ausgelagert. Zudem bleibt der externe Hersteller für Anpassungen an neue Regularien verantwortlich, was die Unsicherheit für das Unternehmen minimiert.
- Flexibilität und Fokus auf Kernkompetenzen: Unternehmen können sich auf ihre Stärken wie Produktentwicklung und Innovation konzentrieren, ohne durch regulatorische Anforderungen abgelenkt zu werden. Gleichzeitig bietet ein externer Hersteller Flexibilität in der Organisationsstruktur, indem er die regulatorischen Pflichten übernimmt.
- Strategische Vorteile: Durch die Zusammenarbeit mit einem externen Hersteller erhalten Unternehmen Zugang zu branchenspezifischen Netzwerken und erprobten Prozessen, die den Markteintritt erleichtern. Außerdem entfällt die Notwendigkeit, regulatorisches Wissen intern aufzubauen und zu pflegen, was den Aufwand erheblich reduziert.
Diese Vorteile machen die Auslagerung der Hersteller-Rolle zu einer attraktiven Option, insbesondere für Unternehmen, die schnelle Ergebnisse erzielen und gleichzeitig Risiken sowie Komplexität minimieren möchten.
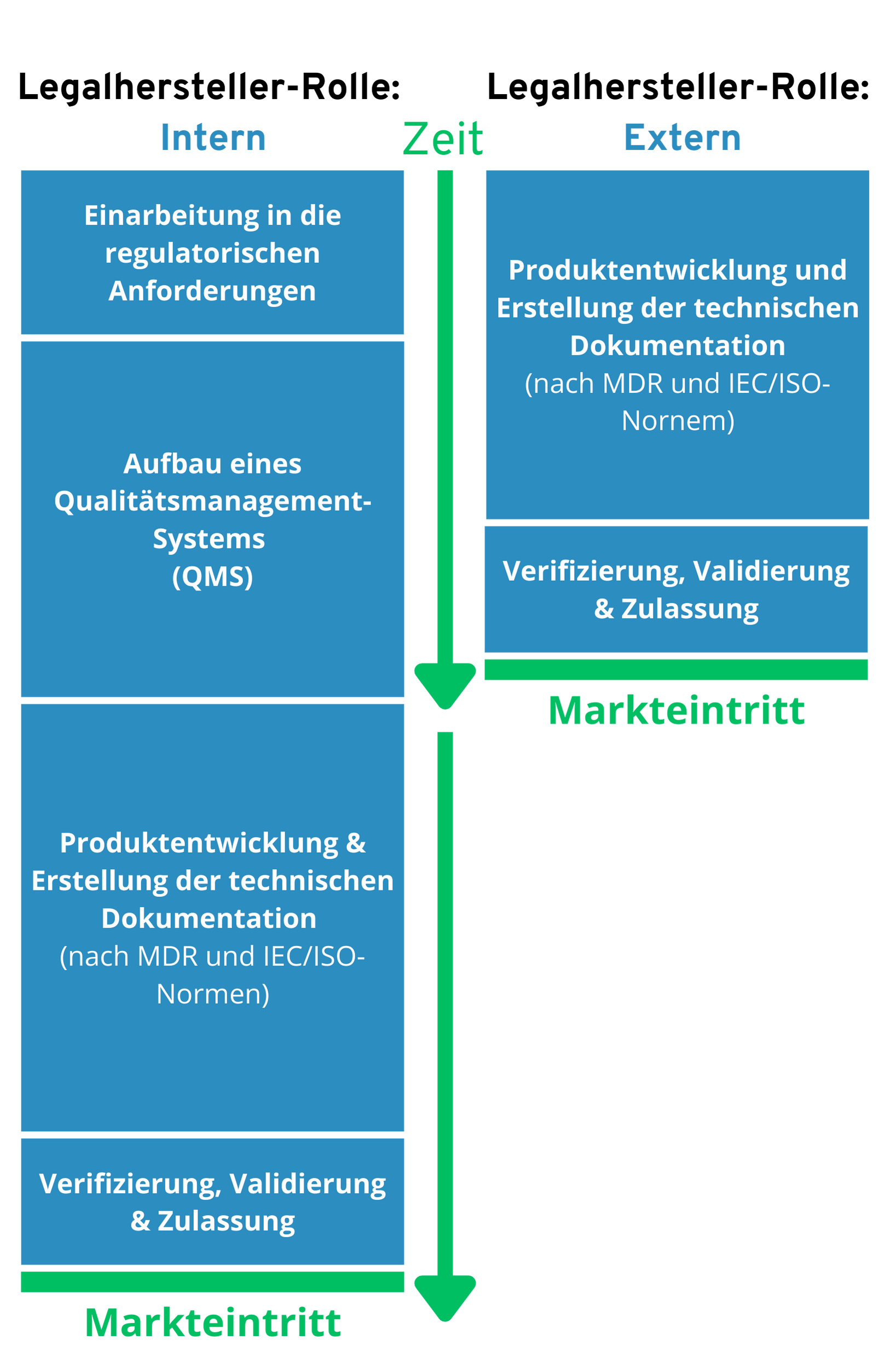
Zeit bis Markteintritt – Vergleich:
Legalhersteller-Rolle Intern vs. Extern
(Beispielhaft für Risikoklasse I nach MDR)
4. Ablauf einer solchen Zusammenarbeit zur Auslagerung der Legalhersteller-Rolle
Wenn Sie die Auslagerung der Hersteller-Rolle mit uns als Dienstleister angehen möchten, erstellen wir zu Beginn einen individuellen Projektplan, der auf Ihre Situation zugeschnitten ist. Wichtig ist initial erstmal die Bestimmung der Verantwortlichkeitsverteilung. Hierfür sollten u.a. folgende Fragen beantworten:
- Möchten Sie die Software-Entwicklung auslagern oder Ihr eigenes, internes Team hierfür nutzen? Beide Optionen sind grundsätzlich möglich. Wir können die gesamte Produktentwicklung von technischer und regulatorischer Seite für Sie übernehmen oder auch nur einzelne Leistungen ergänzen, die Sie nicht intern abbilden können.
- Möchten Sie die Content-Entwicklung für die Software (medizinische Texte, Bilder, Videos, Audio) selbst übernehmen oder auslagern? Beide Optionen sind prinzipiell möglich. Es ist auch möglich, dass Sie den Content inhaltlich vorbereiten und wir die finale Editierung und visuelle Gestaltung übernehmen.
- Möchten Sie den Kunden-Support (Kontakt-Hotline) selbst anbieten oder auch an uns als Dienstleister auslagern? Beide Optionen sind prinzipiell möglich. Wenn Sie diesen Service inhouse übernehmen, schulen wir Sie in Bezug auf die relevanten regulatorischen Pflichten.
Nach Bestimmung der Verantwortlichkeitsverteilung besteht der finale Projektplan z.B. aus den folgenden Schritten:
- 1. Definition der Zweckbestimmung und Risikoklasse nach MDR
- 2. Produktentwicklung:
- a. Erstellung der technischen Dokumentation unter Einhaltung aller Normen & Standards
- b. Software-Entwicklung unter Einhaltung aller Normen & Standards
- 3. Verifizierung & Validierung des Produkts (inkl. klinische Bewertung, summative Usability-Evaluation, Cyber-Security-Validierung etc.)
- 4. Registrierung des Medizinprodukts durch Selbstzertifizierung (Risikoklasse I) bzw. Konformitätsbewertungsverfahren mit benannter Stelle (Risikoklasse IIa und höher)
- 5. Weiterentwicklung des Produkts sowie Überwachung nach dem Inverkehrbringen (Post Market Surveillance, Post-Market-Clinical-Follow-Up, Vigilanz, Wartung, Betrieb, …)
Achtung: Dieser Ablauf ist stark vereinfacht und soll Ihnen nur ein Grundverständnis geben.
Für alle genannten Schritte übernehmen wir gern die federführende Rolle und leiten Sie durch den Prozess. Selbstverständlich haben Sie weiterhin die volle Kontrolle und treffen die relevanten Geschäftsentscheidungen.
Kontakt aufnehmen:
Sie möchten die Legalhersteller-Rolle auslagern?
Wir bieten diesen Service für Software-Medizinprodukte und DiGA an.
Kontaktieren Sie uns hierzu: Mehr Informationen zur Kontaktaufnahme
5. Wichtige Fragen und Antworten
Hier gehen wir auf wichtige Fragen ein, die bei der Auslagerung der Hersteller-Rolle erfahrungsgemäß aufkommen.
5.1. Ich möchte die Hersteller-Rolle auslagern, um das Produkt schneller auf den Markt zu bringen. Später möchte ich die Hersteller-Rolle für das Produkt aber wieder selbst übernehmen. Ist das möglich?
Ja, das ist absolut möglich. Sie behalten die Intellectual Property (IP) am Produkt und der gesamten Dokumentation. Daher ist es für Sie zu jedem Zeitpunkt möglich, das Produkt umzumelden und selbst die Hersteller-Rolle zu übernehmen. So profitieren Sie von einem schnellen Marktstart Ihres Produkts und können die Regulatorik mittelfristig wieder inhouse übernehmen. Wir helfen Ihnen dabei, diesen Übergang reibungslos zu absolvieren.
5.2. Behalte ich alle Besitzrechte am Produkt?
Ja, sie haben die komplette Intellectual Property (IP) am Produkt und der Dokumentation. QuickBird Medical bietet Ihnen lediglich einen Service an, um Ihnen beim Launch eines regulierten Software-Medizinprodukts zu helfen. Sie haben die volle Kontrolle und Besitzrechte am Produkt.
5.3. Ist das teurer als die Themen inhouse zu übernehmen?
Das hängt natürlich von einer Vielzahl von Faktoren ab. Allerdings ist es unsere Erfahrung, dass die Auslagerung der Hersteller-Rolle insgesamt zu Kosteneinsparungen führt.
Aus folgenden Gründen können Kosteneinsparungen realisiert werden:
- Kein Aufbau eines QMS nötig: Das Qualitätsmanagementsystem (QMS) existiert bereits und ist bei QuickBird Medical nach ISO 13485 zertifiziert. Sie müssen keine Kosten für den Aufbau und die Zertifizierung eines QMS zahlen.
- Kein Aufbau eines ISMS nötig: Das Informationssicherheitsmanagementsystem (ISMS) existiert bereits und ist bei QuickBird Medical nach ISO 27001 zertifiziert. Sie müssen keine Kosten für den Aufbau und die Zertifizierung eines ISMS zahlen.
- Geschultes, effizientes Team: Das QuickBird Medical-Team ist durch zahlreiche Projekte sehr effizient in der Erstellung der technischen Dokumentation für Software-Medizinprodukte. Daher fallen geringere Aufwände an, als wenn ein ungeschultes Team diese Aufgabe übernehmen würde.
- Auslastungsspitzen und -täler: Nach Veröffentlichung des Produkts wird der Aufwand für das Regulatorik- und Software-Team erfahrungsgemäß geringer als für den initialen Launch. Für das externe Team fallen dann nur Kosten an, wenn auch Arbeit getan wird. Eine interne Vollzeit-Person muss kontinuierlich bezahlt werden – auch wenn die Arbeitslast niedriger wird.
5.4. Wer haftet für das Produkt im regulatorischen Sinne, z.B. bei Patientenschäden?
Im Rahmen der regulatorischen Pflichten nach MDR übernimmt der externe Inverkehrbringer (z. B. QuickBird Medical) die volle Haftung für das Produkt. Das bedeutet, QuickBird Medical gewährleistet nicht nur die Einhaltung aller regulatorischen Anforderungen, sondern trägt auch die Verantwortung im Schadensfall – etwa bei Patientenschäden. Sie können das mit Medizinprodukten verbundene Risiko also auf diese Weise erfolgreich auslagern.
QuickBird Medical besitzt als Medizinprodukt-Hersteller eine rechtlich verbindliche Haftpflichtversicherung für Personenschäden. Außerdem werden wir 4-mal jährlich durch externe Parteien auditiert, um die regulatorische Compliance sicherzustellen.
5.5. Kann die Hersteller-Rolle für eine DiGA ausgelagert werden?
Ja, QuickBird Medical ist sowohl nach ISO 13485 für Qualitätsmanagement als auch nach ISO 27001 für Informationssicherheitsmanagment zertifiziert. Damit erfüllen wir die Voraussetzungen, um als DiGA-Hersteller aufzutreten und übernehmen diesen Service auch schon für existierende DiGA-Kunden.
5.6. Kann ich meine Hersteller-Rolle für ein zertifiziertes Medizinprodukt nachträglich auslagern?
Ja, das ist möglich. Wir überprüfen und überführen dann Ihre existierende technische Dokumentation. Danach kann das Medizinprodukt zu uns als neuen Legalhersteller umgemeldet werden. Je nachdem, ob eine benannte Stelle involviert ist, müssen weitere Formalitäten beachtet werden.
5.7. Kann ich das Produkt nach dem Inverkehrbringen weiterentwickeln?
Sie können natürlich jederzeit Änderungen am Produkt vornehmen. Diese Erweiterungen werden bewertet und durchlaufen dann unsere Qualitätsmanagementprozesse vor der Veröffentlichung, um die regulatorische Compliance sicherzustellen. Das Ganze funktioniert in einem agilen Entwicklungszyklus zur regelmäßigen Veröffentlichung neuer Funktionen.
5.8. Kann ich weiterhin ein eigenes Entwicklerteam nutzen?
QuickBird Medical kann für Sie die gesamte Entwicklung sowie die externe Legalhersteller-Rolle nach MDR übernehmen.
Auf der anderen Seite ist es aber auch möglich, ein internes Entwicklerteam bei Ihnen für die Umsetzung des Produkts zu nutzen und weiterhin die Hersteller-Rolle auszulagern.
6. Beispiele für Medizinprodukte-Hersteller mit externem Inverkehrbringer
Um das Ganze ein wenig greifbarer zu machen, finden Sie hier zwei Beispiele für Firmen, für welche QuickBird Medical die Legalhersteller-Rolle übernimmt:
- Mamly: Mamly ist eine zugelassene Medizinprodukt-App zur Behandlung von peripartaler Depression. Sie hilft Schwangeren mit Achtsamkeitstraining und professioneller Unterstützung dabei, psychische Belastungen zu reduzieren.
Zur Case-Study - Kontina: Kontina ist eine zugelassene Medizinprodukt-App zur Behandlung einer überaktiven Blase (OAB) durch Training, Lerninhalte und ein Blasentagebuch zur Symptomreduktion.
Zur Case-Study
7. Fazit: Für wen lohnt es sich, die Hersteller-Rolle auszulagern?
Wann lohnt es sich gegebenenfalls nicht, die Rolle des Legalherstellers auszulagern?
- Sie haben bereits viel Regulatorik-Expertise inhouse und ein Qualitätsmanagement-Team, das sich mit Software-Medizinprodukten auskennt? -> Dann sollten Sie dieses Team nutzen und selbst der Legalhersteller werden.
- Sie haben mehrere Software-Medizinprodukte auf dem Markt -> Je mehr Software-Medizinprodukte Sie haben, desto höher werden die Synergie-Effekte eines eigenen Qualitätsmanagement-Teams.
Wann lohnt es sich? Wenn Sie folgende Ziele haben, kann sich die Auslagerung der Legalhersteller-Rolle an uns als Dienstleister lohnen:
- Sie möchten möglichst schnell Ihr Produkt auf den Markt bringen, um Umsätze zu generieren.
- Sie möchten regulatorische Komplexität und interne Aufwände vermeiden, die eine Distraktion vom Kerngeschäft darstellen.
- Sie möchten rechtliche Haftungsrisiken für das Medizinprodukt auslagern.
Wichtig ist, dass Sie sich strategisch überlegen, welches Szenario für Sie mehr Sinn ergibt.
Gerne beraten wir Sie dabei. Wenn Sie eine medizinische Software planen und einen Partner für die Umsetzung suchen, kontaktieren Sie uns jederzeit. Als spezialisierter Dienstleister liegt unser Fokus auf der regulatorisch-konformen Entwicklung von medizinischen Apps und Gesundheitssoftware.
Kontakt aufnehmen:
Sie möchten die Legalhersteller-Rolle auslagern?
Wir bieten diesen Service für Software-Medizinprodukte und DiGA an.
Kontaktieren Sie uns hierzu: Mehr Informationen zur Kontaktaufnahme




