Wie entscheidet sich eigentlich, ob mein Produkt ein Medizinprodukt ist? Wo fange ich an, wenn ich seine Risikoklasse bestimmen möchte? Und mit welchen Aussagen darf ich mein Produkt am Ende bewerben? Die Antworten auf diese und viele weitere Fragen lassen sich auf Basis Ihrer Zweckbestimmung beantworten – und die schreiben Sie selbst als Hersteller.
In diesem Artikel erhalten Sie eine praktische Anleitung zur Erstellung Ihrer Zweckbestimmung nach MDR. Dabei fokussieren wir uns auf Softwareprodukte, wie mobile Apps und Webanwendungen. Die Konzepte und Definitionen sind aber auf jedes andere Medizinprodukt übertragbar.
Inhalt
- 1. Mit 3 Fragen zur Zweckbestimmung
- 2. Zweckbestimmung – das Fundament Ihres Medizinprodukts
- 3. Fazit
Bevor Sie sich Hals über Kopf in Ihr neues Projekt stürzen, ein Entwicklerteam zusammenstellen und schon über die Vermarktung nachdenken, lassen Sie uns einen Schritt zurückgehen und von vorne beginnen: bei der Zweckbestimmung. Denn erst, wenn diese steht, wissen Sie, welche regulatorischen Anforderungen auf Sie zukommen und wie Sie Ihr Produkt am Ende bewerben dürfen.
Die Zweckbestimmung legt das Fundament für (fast) alles. Ganz zu Beginn eines Software-Projekts lässt sich damit nämlich die wohl wichtigste Frage überhaupt beantworten: ist Ihre Software ein Medizinprodukt und müssen Sie sich daher an die Vorgaben der Medical Device Regulation (MDR) halten?
Beispiel: Angenommen, Sie wollen eine App entwickeln, die die körperliche Beweglichkeit von Menschen steigert, indem Sie basierend auf Nutzereingaben ein individuelles Trainingsprogramm erstellt. Die Trainingsinhalte bestehen aus Informationen über den Bewegungsapparat und diversen Dehnübungen. Eine mögliche (sehr vereinfachte) Zweckbestimmung könnte lauten:
Die App ist dazu bestimmt, die Beweglichkeit von gesunden Erwachsenen zu steigern.
In diesem Fall würde sich die Software nicht als Medizinprodukt qualifizieren, da sie nicht der Definition der MDR entspricht. Grob zusammengefasst besagt diese nämlich, dass nur Apps, die einen Zweck in Zusammenhang mit einer Krankheit oder Behinderung verfolgen, als Medizinprodukt gelten. Dazu zählen unter anderem Diagnose, Therapie und Kompensierung (die genaue Definition finden Sie in unserem Artikel zum Thema: Leitfaden: Ist Ihre App ein Medizinprodukt?). Demnach ändert sich die Situation für Ihre Software, wenn Sie die Zweckbestimmung leicht abändern:
Die App ist dazu bestimmt, die Beweglichkeit von Menschen nach einer Beinamputation zu steigern und Strategien zur Kompensation der Behinderung aufzubauen.
So schnell kann es gehen! Durch die Veränderung eines einzelnen Satzes haben Sie Ihre App zu einem Medizinprodukt gemacht. Dazu waren nicht einmal Änderungen an der Software notwendig.
1. Mit 3 Fragen zur Zweckbestimmung
Um eine Zweckbestimmung zu schreiben, benötigen Sie keine jahrelange Erfahrung im regulatorischen Bereich. Mit genügend Expertise in Bezug auf Ihr Produkt und Ihre Zielgruppe können Sie diese auch ohne große Vorkenntnisse allein verfassen. Lassen Sie ihre Zweckbestimmung aber am besten am Ende noch einmal von einem Regulatorik-Experten überprüfen.
Die MDR definiert die Zweckbestimmung folgendermaßen:
„Zweckbestimmung“ bezeichnet die Verwendung, für die ein Produkt entsprechend den Angaben des Herstellers auf der Kennzeichnung, in der Gebrauchsanweisung oder dem Werbe- oder Verkaufsmaterial bzw. den Werbe- oder Verkaufsangaben und seinen Angaben bei der klinischen Bewertung bestimmt ist;
Diese Definition lässt drei Fragen ableiten, welche für die Inhalte der Zweckbestimmung zentral sind:
- “Was soll auf meiner Produkt-Webseite stehen?”: Versetzen Sie sich in die Lage Ihres Endkunden und überlegen Sie sich, welche Informationen er benötigt, um eindeutig zu wissen, dass Ihr Produkt für ihn geeignet ist und welchen Mehrwert es ihm liefern kann.
- “Welche Versprechen kann das Produkt auch halten?”: Leere Versprechungen sind tabu. Daher dürfen Sie auch nur jene Punkte nennen, die Sie innerhalb der klinischen Bewertung auch nachweisen können.
- „Was kann das Produkt nicht?“ (falls notwendig): Manchmal ist es auch notwendig, die Grenzen des Produkts zu thematisieren. Darunter zählt zum Beispiel der Hinweis, dass ein Produkt nur einmal zu verwenden ist.
1.1 Was die Zweckbestimmung nicht enthält
Die MDR versteht die Zweckbestimmung als Teil der Produktbeschreibung und Spezifikation (MDR Artikel 1, Anhang II). Zusätzlich zur Zweckbestimmung enthält diese noch weitere Punkte, die eng miteinander verwandt sind:
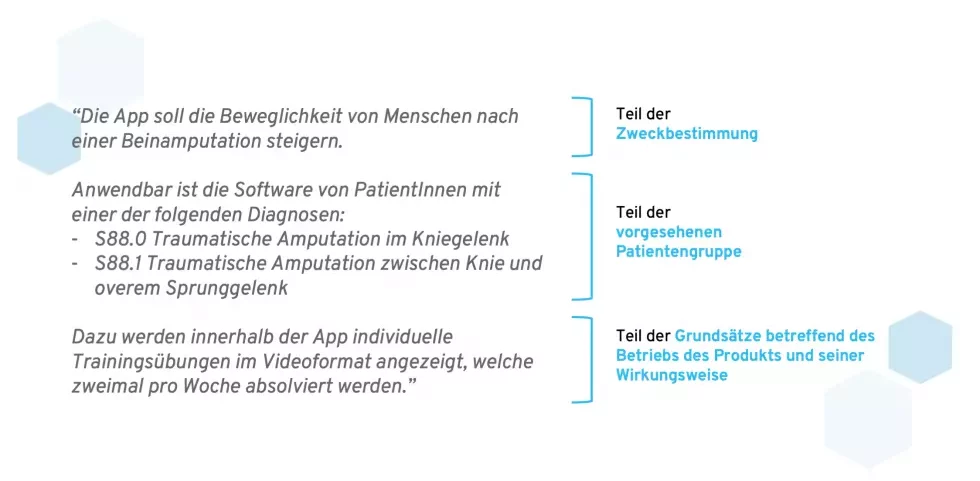
- die vorgesehene Patientengruppe (z.B. ICD-Codes, demografische Daten, Kontraindikationen)
- die Grundsätze betreffend den Betrieb des Produkts und seine Wirkungsweise (Beschreibung der Funktionalitäten und wie der Zweck erreicht werden soll)
Was die Zweckbestimmung enthält – und was sie nicht enthält
Viele Hersteller vermischen diese Punkte miteinander. Das passiert auch zwangsläufig, da eine strikte Trennung dieser Themen nicht möglich ist. Dennoch sollte die Zweckbestimmung nicht allzu detailliert auf die Patientengruppe und die Funktionsweise des Produkts eingehen.
Bei der Unterscheidung können folgende Fragen helfen:
- Zweckbestimmung: WAS soll das Produkt bezwecken?
- Patientengruppe: WER soll das Produkt verwenden?
- Grundsätze betreffend des Betriebs des Produkts und seiner Wirkungsweise: WIE funktioniert das Produkt und wie soll es seinen Zweck erfüllen?
1.2 Wie lang muss eine Zweckbestimmung sein?
Ist es falsch, die Patientengruppe und die Funktionalitäten der Software bereits in der Zweckbestimmung detailliert zu erklären? Nein, aber unter Umständen unklug. Denn eine Zweckbestimmung kann im Nachhinein nicht mehr ohne weiteres geändert werden. Grundsätzlich gilt: Die Zweckbestimmung sollte so präzise wie möglich geschrieben sein. Die Schwierigkeit besteht darin, relevante Informationen von irrelevanten zu trennen.
Denn bestimmt möchten Sie Ihr Produkt nach Markteintritt noch weiterentwickeln und um Features ergänzen. Vielleicht sind gewisse Anpassungen sogar notwendig, um die Produktsicherheit zu erhöhen. In diesen Fällen kann es problematisch sein, wenn Ihre Zweckbestimmung die Funktionsweise der App schon im Detail erklärt. Das Gleiche gilt, wenn Sie Ihre Patientenpopulation im Nachgang erweitern wollen oder gezwungen sind, diese einzugrenzen.
Es ist also eine Kunst, alle relevanten Aspekte in der Zweckbestimmung zu erwähnen und dabei nicht zu weit auszuholen.
Hinweis: Bei der Formulierung der Zweckbestimmung gibt es nicht einen einzigen richtigen Weg. Die Zweckbestimmung Ihres Produkts kann viele Formen haben, welche potenziell zulässig sind.
Die Länge der Zweckbestimmung ist sehr produktabhängig. Sie ist so lang wie nötig, um Fehlinterpretationen auszuschließen, sollte das Produkt aber auch nicht zu detailliert beschreiben. Manche Zweckbestimmungen beinhalten nur zwei Sätze, andere sind weitaus detaillierter. An dieser Stelle helfen bestimmt ein paar Beispiele von existierenden Medizinprodukten, um Ihnen eine Orientierung zu geben.
Beispiele
Zweckbestimmung für Skalpellklingen:
- „Sterile Skalpellklingen sind dazu vorgesehen, in aufbereitete Skalpellgriffe aufgenommen zu werden. Sterile Skalpelle sind für Hautoberflächenschnitte (Hautinzision) am menschlichen Körper bestimmt.“
Zweckbestimmung für einen Ballonkatheter:
- „Ballonkatheter sind zur routinemäßigen oder postoperativen Drainage der Blase vorgesehen. Der Einsatz von Ballonkathetern ist nur für urologische Zwecke geeignet. Die Produkte sind nur für den Einmalgebrauch zugelassen und die empfohlene maximale Verweildauer für transurethrale Silikonkatheter beträgt 30 Tage. Die Anwendung darf nur durch qualifiziertes Fachpersonal erfolgen.“
Zweckbestimmungen für DiGA:
- Die Zweckbestimmungen aller aktuell gelisteten DiGA, welche ebenfalls Medizinprodukte darstellen, finden Sie im Verzeichnis des BfArM. Wenn Sie sich unsicher sind, ob es sich bei Ihrer App um eine DiGA handelt, finden Sie hier eine Antwort: Ist Ihre App eine DiGA? Definition & Kriterien digitaler Gesundheitsanwendungen
2. Zweckbestimmung – das Fundament Ihres Medizinprodukts
In der MDR gibt es keine konkrete Liste mit Inhalten, welche in der Zweckbestimmung angeführt werden sollen. Jedoch wird die Zweckbestimmung in vielen Kapiteln erwähnt und als Grundlage für zahlreiche Aktivitäten innerhalb des Softwarelebenszyklus aufgeführt.
Einflussbereiche der Zweckbestimmung nach MDR (kein Anspruch auf Vollständigkeit)
Im Folgenden sind zentrale Punkte aufgeführt, welche von der Zweckbestimmung beeinflusst werden und somit bei ihrer Formulierung berücksichtigt werden müssen.
2.1 Qualifizierung als Medizinprodukt
Die Zweckbestimmung muss klar erkennen lassen, dass das Produkt einen medizinischen Zweck hat. Gemäß der Definition der MDR zählen dazu mitunter die Diagnose, Überwachung und Vorhersage von Krankheiten, sowie die Kompensation von Behinderungen. Die genaue Definition finden Sie in diesem Artikel: Leitfaden: Ist Ihre App ein Medizinprodukt?
2.2 Risikoklassifizierung des Medizinprodukts
Nachdem Sie das Produkt als Medizinprodukt qualifiziert haben, folgt die Evaluierung der Risikoklasse. Konkrete Informationen zur richtigen Risikoklasse finden Sie in diesem Artikel.
Um die Risikoklasse möglichst eindeutig bestimmen zu können, muss die Zweckbestimmung entsprechend präzise formuliert sein. Auch Ausschlüsse (Zwecke, für die das Produkt nicht vorgesehen ist), können, wenn notwendig, angegeben werden. Dies ist der Fall, wenn eine andere Interpretation der Zweckbestimmung zu einer höheren Risikoklasse führen könnte.
Beispiel für einen Ausschluss: Das Produkt liefert keinerlei Informationen an den behandelnden Arzt und stellt kein diagnostisches Instrument dar.
Daher kann es auch sein, dass Sie auf bestimmte Funktionalitäten der Software eingehen müssen, wenn diese die Risikoklasse des Produkts beeinflussen. Sollten Fehlinterpretationen möglich sein, welche die Risikoklasse verändern, sind Diskussionen mit den benannten Stellen oder Aufsichtsbehörden vorprogrammiert.
Hinweis: Wenn Sie eine Digitale Gesundheitsanwendung (DiGA) entwickeln möchten, darf Ihr Produkt nur in Klasse I, IIa oder IIb fallen. Achten Sie also darauf, dass das Produkt gemäß seiner Zweckbestimmung nicht in Klasse III fallen kann. Weitere Informationen zu DiGA finden zum Beispiel hier: Leitfaden zur DiGAV: Digitale-Gesundheitsanwendungen-Verordnung
2.3 Risikoanalyse
Im Zuge des Risikomanagements müssen Sie eine Risikoanalyse für Ihr Produkt durchführen. Auch dafür liefert die Zweckbestimmung maßgeblichen Input. Zentral ist die Frage, wie kritisch die Aufgaben sind, die Ihr Produkt wahrnimmt und wie sensibel das Anwendungsgebiet ist. Wenn Ihre App beispielsweise zur Früherkennung von Herzinfarkten bestimmt ist, können bei Fehlfunktionen oder Falschanwendungen gravierende Schäden entstehen. Während von einer App zur Steigerung der Konzentrationsfähigkeit bei ADHS-PatientInnen weniger große Schäden zu erwarten sind.
Die möglichen Schäden sollten sich aus der Zweckbestimmung ableiten lassen, um in der Risikoanalyse evaluiert werden zu können.
Software Safety Class
Wenn Sie ein Software-Produkt planen, werden Sie sich zwangsläufig auch mit der IEC 62304 auseinandersetzen müssen. Mit dieser Norm lässt sich Ihre Anwendung einer Software Safety Class zuordnen. Die grundlegende Frage dabei lautet:
„Wie groß ist der Schaden, der eintreten kann, wenn Ihre Software eine Fehlfunktion aufweist oder sogar komplett versagt?“
Die Software Safety Class beschreibt unter anderem, wie granular Ihre Software während des Entwicklungsprozesses getestet werden muss und kann demnach zusätzlichen Aufwand bedeuten. Da die Software Safety Class oft aus der Risikoanalyse abgeleitet wird, hängt auch diese Einstufung mit Ihrer Zweckbestimmung zusammen.
2.4 Klinische Bewertung und Post-Market-Surveillance
Nur, wenn ein Produkt auch eine klare Zweckbestimmung hat, kann im Zuge einer klinischen Bewertung gezeigt werden, dass sie diesen Zweck auch erfüllt. Die Zweckbestimmung legt also den Grundstein für die Sicherheits- und Leistungsanforderungen, welche im Zuge der klinischen Bewertung berücksichtigt werden. In manchen Fällen wollen Hersteller den Aufwand einer klinischen Prüfung umgehen und berufen sich daher auf „gleichartige Produkte“. Ein zentraler Punkt für die Gleichartigkeit zweier Produkte ist eine identische Zweckbestimmung (MDCG 2020-5). Hier erfahren Sie mehr über die klinische Bewertung und die Kriterien für die Gleichartigkeit von Produkten: MDR-Guide: Klinische Bewertung von Software-Medizinprodukten
Für mehr Informationen zur Validierung im Allgemeinen sollten Sie unseren Artikel zu diesem Thema lesen: Validierung von Medizinprodukt-Software nach MDR
Wenn eine klinische Prüfung geplant ist, ist es auch von Ihrem Budget abhängig, welche Effekte nachgewiesen werden sollen. In der Zweckbestimmung dürfen nur Leistungsmerkmale angegeben werden, für die es auch einen Nachweis gibt.
Auch in der Post-Market-Surveillance Phase werden Daten über das Produkt gesammelt. Welche Daten dabei zu berücksichtigen sind, wird von der Zweckbestimmung abgeleitet (z.B. Lebensqualität, Dauer einer Reha, etc.).
3. Fazit
Die Zweckbestimmung ist das zentrale Element bei der Entwicklung einer Software als Medizinprodukt. Sie legt unter anderem den Grundstein für folgende Punkte:
- Qualifikation als Medizinprodukt
- Risikoklasse & Software Safety Class
- Risikokanalyse
- Klinische Bewertung & Post-Market-Surveillance Daten
Die Zweckbestimmung für Ihre Software sollte möglichst zu Beginn des Entwicklungsprozesses verfasst werden. Dabei sollte darauf geachtet werden, alle notwendigen Informationen zu inkludieren, aber nicht zu tief ins Detail zu gehen.
Falls Sie eine Medical Software oder DiGA planen und Unterstützung bei der Entwicklung benötigen, setzen Sie sich gerne mit uns in Kontakt und wir besprechen das Ganze zusammen unverbindlich. Wir entwickeln Medical Software für Unternehmen und Forschungseinrichtungen auf Auftragsbasis.
Weitere Fragen? Rufen Sie uns gerne an (+49 (0) 89 54998380) oder schreiben uns eine Email (kontakt@quickbirdmedical.com).