Was Ende 2019 in Deutschland begann, wurde 2023 vom Nachbarn Frankreich aufgegriffen: Der DiGA-Fast-Track hat mit „PECAN“ nun ein französisches Gegenstück.
Was in Deutschland als „digitale Gesundheitsanwendung“ (DiGA) bezeichnet wird, heißt in Frankreich „Dispositifs Médicaux Numériques“ (DMN) und im internationalen Kontext „Digital Medical Device“ (DMD).
Für Hersteller entsteht damit ein strukturiertes Schnellverfahren, um digitale Medizinprodukte für einen zeitlich begrenzten Zeitraum über die gesetzliche Krankenversicherung in Frankreich erstatten zu lassen.
In diesem Beitrag liefern wir einen Leitfaden, der erklärt …
- wie PECAN funktioniert,
- inwiefern das Verfahren vom deutschen Erstattungsweg abweicht,
- welche Anforderungen gelten,
- und warum ein Transfer einer DiGA nach Frankreich zwar naheliegt, in der Praxis aber anspruchsvoll ist.
Überblick
- 1. Hintergrund: DiGA-Modell in Deutschland
- 2. Einführung: Erstattung von DMD in Frankreich: PECAN
- 3. Regulatorischer Rahmen des PECAN
- 4. Antragsverfahren des PECAN
- 5. Verfahren nach positiver PECAN-Entscheidung
- 6. Kostenerstattung von DMD
- 7. Klinische Bewertung im PECAN-Verfahren
- 8. Akteure und Zuständigkeiten
- 9. Stand 2026: DiGA-Verzeichnis von Frankreich
- 10. Vergleich: DiGA Fasttrack vs. DMD und PECAN
- 11. Von Deutschland nach Frankreich: DiGA zu PECAN
- 12. Hilfreiche Links
- 13. DiGA-Modelle in anderen Ländern
- 14. Fazit: Das DMD-Framework als DiGA mit Zusätzen
1. Hintergrund: DiGA-Modell in Deutschland
Seit 2019 gibt es in Deutschland mit dem DiGA-Fast-Track einen standardisierten Erstattungsweg für „Digitale Gesundheitsanwendungen“ (DiGA). Hersteller können beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) einen Antrag auf Aufnahme in das DiGA-Verzeichnis stellen. Im Rahmen des Fast-Tracks prüft das BfArM, ob die Anwendung die regulatorischen und formalen Anforderungen erfüllt (u. a. MDR/CE, Datenschutz/IT-Sicherheit) und ob ein positiver Versorgungseffekt nachgewiesen ist. Bei positiver Entscheidung wird die DiGA in das Verzeichnis aufgenommen und ist anschließend über die gesetzlichen Krankenkassen erstattungsfähig.
Der Fast-Track kennt dabei zwei mögliche Einstiegswege:
- Entweder erfolgt direkt eine dauerhafte Aufnahme, wenn der Nutzennachweis bereits vollständig vorliegt,
- oder eine vorläufige Aufnahme, wenn noch keine vollständige Studie zum positiven Versorgungseffekt existiert. In diesem Fall muss der Hersteller trotzdem ein Evaluationskonzept inklusive Evidenz aus einer Pilotstudie vorlegen. Bei positiver Bewertung wird die DiGA dann erstattet, während der Hersteller im sogenannten Erprobungsjahr die fehlenden Daten für eine vollständige Studie nachreicht. Erst nach erfolgreichem Abschluss kann die Anwendung dauerhaft im DiGA-Verzeichnis verbleiben.
Das französische Modell lehnt sich an dieses deutsche Modell zur Erstattung von digitalen Gesundheitsanwendungen an, hat aber gleichzeitig einige fundamentale Unterschiede.
2. Einführung: Erstattung von DMD in Frankreich: PECAN
PECAN steht für „Prise en Charge Anticipée Numérique“. Wörtlich: vorläufige digitale Kostenübernahme. Das Verfahren ermöglicht es Herstellern seit 2023, digitale Medizinprodukte mit vermutetem Innovationscharakter für maximal zwölf Monate vorläufig über die gesetzliche Krankenversicherung zu erstatten.
Frankreich hat mit PECAN vor allem die Idee der vorläufigen Erstattung aus dem DiGA-Fast-Track aufgegriffen. Der zentrale Unterschied zu Deutschland ist nämlich, dass der Übergang in die dauerhafte Erstattung nicht im selben Verfahren erfolgt. Die dauerhafte Erstattung muss anschließend über einen separaten regulären Weg (LPPR oder LATM) beantragt werden, der schon lange vor PECAN existierte.
Digitale Gesundheitsanwendungen werden in Frankreich zudem nicht als DiGA bezeichnet, sondern als „Dispositifs Médicaux Numériques“ (DMN) und im internationalen Kontext als „Digital Medical Devices“, kurz DMD.
3. Regulatorischer Rahmen des PECAN
Die rechtliche Grundlage des PECAN-Verfahrens ist Artikel L. 162-1-23 des französischen Sozialversicherungsrechts (Code de la Sécurité Sociale, CSS). Damit ist PECAN gesetzlich verankert und als vorläufiger Erstattungsmechanismus rechtlich verbindlich geregelt.
Zusätzlich stellt die französische Gesundheitsbehörde Haute Autorité de Santé (HAS) einen Leitfaden zur Verfügung, der Herstellern als praktisches Handbuch dienen soll. Er beschreibt nicht nur die wissenschaftlichen Anforderungen an die Nutzenvermutung, sondern konkretisiert auch die formalen Kriterien für technische Nachweise, insbesondere zu Interoperabilität und IT-Sicherheit. Ergänzend enthält das Dokument aktuelle Praxisbeispiele. Im Vergleich zum deutschen DiGA-Leitfaden fällt er mit rund 27 Seiten deutlich kompakter aus.
3.1 Anwendungsbereich
Der Anwendungsbereich umfasst zwei Kategorien digitaler Medizinprodukte:
- digitale Medizinprodukte mit therapeutischer Zweckbestimmung und
- digitale Medizinprodukte zur medizinischen Teleüberwachung.
Im Vergleich dazu ist der Anwendungsbereich des deutschen DiGA-Fast-Tracks enger gefasst und schließt keine Telemonitoring-Anwendungen ein.
3.2 Zentrale Prinzipien
Das PECAN-Verfahren folgt laut dem Leitfaden vier Prinzipien, die Hersteller kennen sollten:
- Fast-Track zur vorläufigen Erstattung:
PECAN ist ein gesondertes Verfahren, das der regulären Erstattung vorgelagert ist. - Zeitlich strikt begrenzt:
Die vorläufige Erstattung gilt maximal 12 Monate ab Entscheidung, eine Verlängerung ist ausgeschlossen. Eine weitere Kostenerstattung ist nur über einen separaten Antrag in der Regelversorgung (LPPR oder LATM) möglich. - Kumulative Förderkriterien:
Alle gesetzlichen Voraussetzungen müssen gleichzeitig erfüllt sein. - Technische Zertifizierung:
Zusätzlich zur Bewertung durch die Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé (CNEDiMTS) ist eine Zertifizierung durch die Agence du Numérique en Santé (ANS) erforderlich. Die einzelnen Institutionen werden in Kapitel 8 nochmal detaillierter betrachtet.
3.3 Erstattungskriterien und Anforderungen für DMD in Frankreich
Damit ein DMD für das PECAN-Verfahren infrage kommt, müssen die folgenden Kriterien und Anforderungen erfüllt sein. Wichtig ist dabei: Die Bewertung erfolgt immer indikationsspezifisch. Ein Produkt kann also für eine Indikation PECAN-fähig sein, für eine andere nicht.
3.3.1 Erstattungskriterium 1: CE-Kennzeichnung nach MDR
Kurz gesagt: Ohne CE kein PECAN.
Wie auch in Deutschland gilt: Nicht jede Software ist eine digitale Gesundheitsanwendung, aber jede DMD ist ein Medizinprodukt und unterliegt der Medical Device Regulation (MDR).
Für PECAN bedeutet das:
- Das DMD muss eine gültige CE-Kennzeichnung nach MDR besitzen.
- Die beantragte Indikation muss mit der Indikation für die CE-Zertifizierung nach MDR übereinstimmen.
So wird geprüft:
- Maßgeblich ist die Indikation in der Gebrauchsanweisung.
- Weicht die im PECAN-Antrag genannte Indikation sprachlich oder inhaltlich davon ab, muss der Hersteller dies im Dossier klar begründen und erläutern.
Weitere Informationen zur Zulassung und Zertifizierung von Medizinprodukt-Software nach MDR finden Sie in unserem Leitfaden zum Thema.
3.3.2 Erstattungskriterium 2: Vermutete Innovation
Neben der CE-Kennzeichnung muss das DMD als mutmaßlich innovativ gelten. Entscheidend ist dabei, ob die Technologie:
- einen klinischen Nutzen erwarten lässt
oder - einen messbaren Fortschritt in der Organisation der Versorgung bietet.
Zwei Mindestanforderungen gelten dabei immer:
- Ein organisatorischer Fortschritt darf die Versorgungsqualität nicht beeinträchtigen.
- Für das digitale Medizinprodukt müssen laufende Studien vorliegen, die voraussichtlich genügend Daten liefern, um anschließend die dauerhafte Erstattung beantragen zu können.
Deutschland nutzt hierfür einen ähnlichen Bewertungsansatz: Statt „mutmaßlicher Innovation“ ist im DiGA-Fast-Track der „positive Versorgungseffekt“ entscheidend, der entweder über einen medizinischen Nutzen (mN) oder über eine patientenrelevante Struktur- und Verfahrensverbesserung (pSVV) nachgewiesen werden muss.
3.3.3 Erstattungskriterium 3: Technische Voraussetzungen
Parallel zur Bewertung durch die CNEDiMTS prüft die ANS die technischen Anforderungen.
Konkret muss das DMD:
- die Vorgaben zum Datenschutz erfüllen,
- die nationalen Interoperabilitäts- und IT-Sicherheitsstandards einhalten,
- einen standardisierten, interoperablen Datenexport ermöglichen,
- ggf. Schnittstellen zu Geräten zur Erfassung von Vitalparametern bieten.
Für die dauerhafte Erstattung ist zudem ein offizielles Interoperabilitätszertifikat erforderlich, u. a. im Zusammenspiel mit der französischen nationalen eHealth-ID (INS).
Auch mit dem DiGA-Fast-Track in Deutschland sind Datenschutz, Informationssicherheit und Interoperabilität zentrale Anforderungen.

Erstattungskriterien für PECAN im Vergleich zu DiGA
3.4 Ausschlussgründe
Eine vorläufige Erstattung ist nicht möglich, wenn:
- das DMD bereits eine PECAN-Erstattung für dieselbe Indikation hatte,
- eine PECAN bereits abgelehnt wurde
→ Ausnahme: Neue Daten bei zuvor unzureichender Evidenz, - eine behördliche Aussetzung oder ein Verbot besteht,
- PECAN mit anderen Erstattungsmechanismen kombiniert werden soll (z. B. LPPR, LATM, Innovationspauschale, Übergangserstattung).
4. Antragsverfahren des PECAN
Das Antragsverfahren besteht insgesamt aus drei Phasen.
- Einreichung & formale Prüfung des Dossiers
Der Hersteller reicht das Dossier bei den zuständigen Ministerien für Gesundheit und soziale Sicherheit ein, mit Kopie an die HAS.
In dieser ersten Phase wird geprüft:
- Ist das Dossier vollständig?
- Entspricht es den formalen Anforderungen der HAS?
Falls Unterlagen fehlen, erhält der Hersteller eine Nachforderung.
Frist: 30 Tage, um die fehlenden Informationen nachzureichen. Wer diese Frist verpasst, dessen Antrag wird als „zurückgezogen“ eingeordnet.
- Stellungnahme durch die CNEDiMTS
Bei vollständigem Dossier bewertet die CNEDiMTS die Förderfähigkeit. Im Fokus stehen Indikation und vermutete Innovation.
Die Bewertung erfolgt ohne Rückfragen oder Anhörungen der Antragsteller.
Bearbeitungszeit: maximal 60 Tage ab vollständigem Antrag.
Am Ende steht eine positive oder negative Stellungnahme, die:
- an die Ministerien,
- an den Hersteller,
- und an die betroffenen Fachgremien (CNP) geht und öffentlich auf der HAS-Website veröffentlicht wird.
- Entscheidung über die vorläufige Erstattung
Auf Basis der CNEDiMTS-Stellungnahme entscheiden die zuständigen Ministerien.
Frist: 30 Tage
Die Entscheidung wird per ministeriellem Erlass im „Journal officiel“ veröffentlicht und legt fest:
- ob das Produkt vorläufig erstattet wird,
- und zu welchen finanziellen Bedingungen.
5. Verfahren nach positiver PECAN-Entscheidung
Nach einer positiven PECAN-Entscheidung wird das digitale Medizinprodukt für maximal zwölf Monate vorläufig erstattet. In dieser Zeit muss der Hersteller den Übergang in die dauerhafte Erstattung vorbereiten. PECAN dient quasi als Brücke zur regulären Erstattung:
- Für digitale Medizinprodukte mit therapeutischer Zweckbestimmung ist der reguläre Erstattungsweg die Aufnahme in die Liste der erstattungsfähigen Produkte und Leistungen LPPR. Der Hersteller muss den Folgeantrag innerhalb von 6 Monaten nach der PECAN-Entscheidung einreichen. Auch hierfür stellt die HAS einen Leitfaden bereit.
- Für digitale Medizinprodukte zur medizinischen Teleüberwachung ist der reguläre Erstattungsweg die Aufnahme in die Liste der Aktivitäten der medizinischen Teleüberwachung LATM. Der Hersteller muss den Folgeantrag innerhalb von 9 Monaten nach der PECAN-Entscheidung einreichen. Auch hierfür stellt die HAS einen Leitfaden bereit.
Die untenstehende Abbildung fasst das PECAN-Verfahren und die nachfolgenden regulären Erstattungswege zusammen.
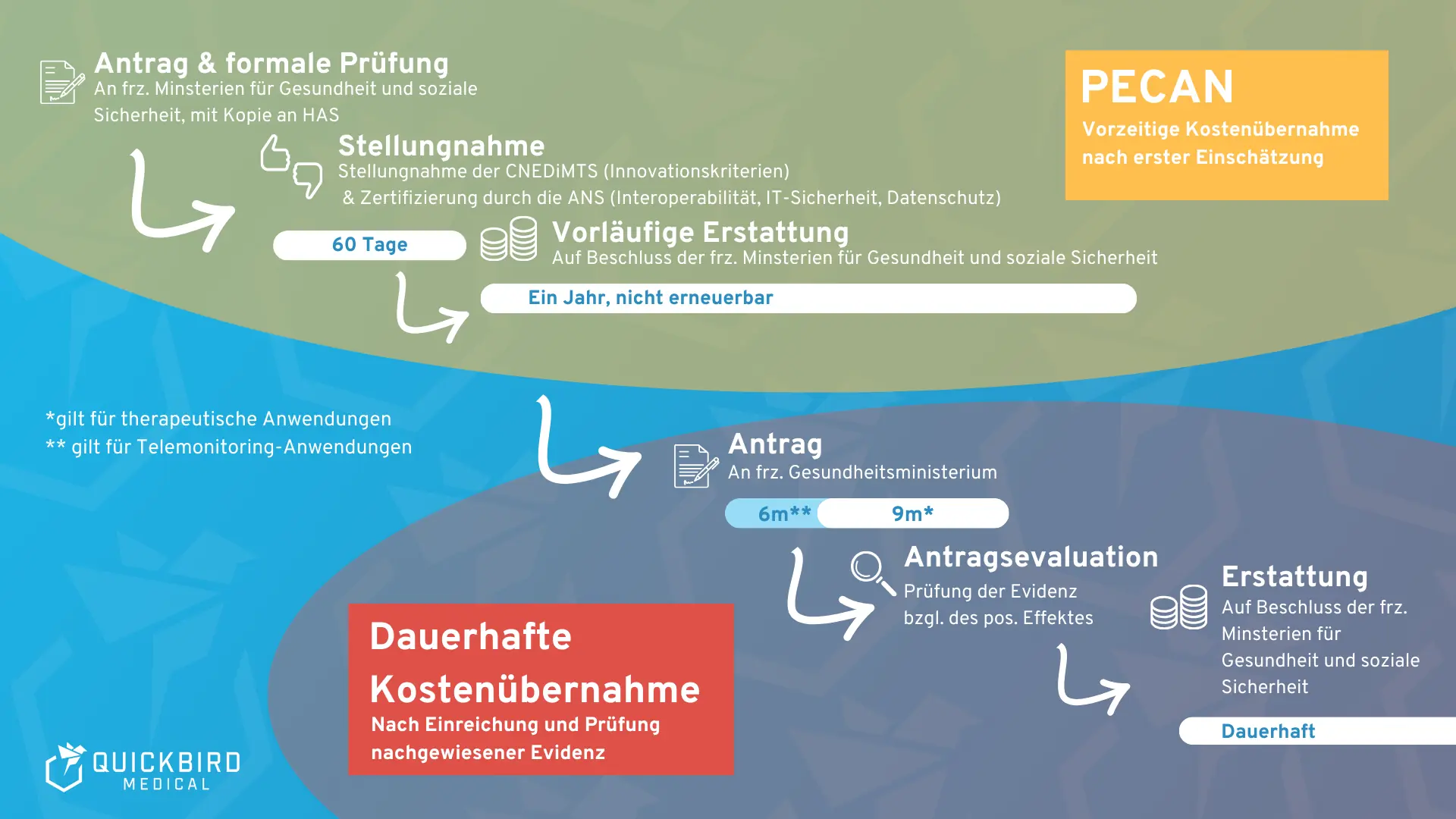
PECAN-Verfahren und anschließender Erstattungsweg der Regelversorgung
6. Kostenerstattung von DMD
Hier gehen wir auf die konkreten Regelungen zur Kostenerstattung von DMD im Rahmen des PECAN und danach ein.
6.1 Erstattungshöhe während des PECAN-Jahrs
Während des PECAN-Verfahrens werden Preise über staatlich definierte Pauschalen geregelt. Diese umfassen für:
Digitale Therapeutika (DTx)
- ein Erstpaket in Höhe von 435 €. Dieses kann einmalig pro Patienten abgerechnet werden. Es gilt für die effektive Nutzung des digitalen Medizinprodukts für maximal 3 Monate.
- Ein Folgepaket, das an das Erstpaket anschließt. Dieses wird anteilig entsprechend der vorgesehenen Verordnungsdauer und der tatsächlichen Nutzung abgerechnet und beträgt 38,30 € pro Monat.
- Die maximale finanzielle Entschädigung, bestehend aus den beiden zuvor genannten Pauschalbeträgen, beträgt 780 € pro Patienten und Jahr.
Weitere Informationen finden Sie im Absatz II des Artikels R. 162-117 des Sozialversicherungsgesetzbuches.
Für Telemonitoring-Lösungen
- erhält der technische Betreiber eine monatliche Pauschale von 50 € bis 91,67 € je nach nachgewiesenem Interesse.
- Die medizinische Überwachungsleistung wird separat vergütet (z. B. ärztlich oder pflegerisch).
Weitere Informationen finden Sie im Artikel L162-52 des Sozialversicherungsgesetzbuches.
6.2 Erstattung nach Ablauf des PECAN-Jahrs
Nach dem PECAN-Jahr endet die Pauschalvergütung. Für die dauerhafte Erstattung wird der Preis anschließend im jeweiligen Regelpfad über LPPR (für DTx) oder LATM (für Telemonitoring-Anwendungen) neu verhandelt, nutzbasiert und unter Einbindung des Comité économique des produits de santé (CEPS).
LPPR für digitale Gesundheitsanwendungen bzw. DTx
Im Regelpfad der LPPR erfolgt die Erstattung als Preis pro Einheit. Wichtig ist dabei, dass der tatsächliche Produktpreis höher sein kann als der Betrag, den die Krankenkasse erstattet. Die Differenz wird dann vom Patienten, seiner Zusatzkrankenversicherung (Mutuelle) oder einer anderen Organisation übernommen.
LATM für Telemonitoring
Im Regelpfad der LATM für Telemonitoring werden pro Patienten zwei Pauschalbeträge erstattet:
- ein Pauschalbetrag, der an den Fernüberwachungsbetreiber gezahlt wird, sowie
- ein Pauschalbetrag, der an den Betreiber gezahlt wird.
Die Sätze für die technischen Pakete werden dabei unter Berücksichtigung des organisatorischen oder klinischen Interesses festgelegt, das von der medizinischen Fernüberwachung zu erwarten ist. Das klinische Interesse wird anhand der Auswirkungen auf die Lebensqualität, die Morbidität oder die Mortalität bewertet.
7. Klinische Bewertung im PECAN-Verfahren
Die klinische Bewertung ist ein zentraler Bestandteil des PECAN-Verfahrens. Die CNEDiMTS prüft dabei, ob ein DMD als mutmaßlich innovativ gelten kann und ob die vorgelegten sowie laufenden Studien geeignet sind, kurzfristig die Grundlage für eine reguläre Erstattung über LPPR oder LATM zu schaffen. Maßgeblich sind dabei die Prinzipien der evidenzbasierten Medizin.
7.1 Evidenzbasiert und kontextabhängig
Die Bewertung erfolgt nicht losgelöst von der Versorgungspraxis. Die CNEDiMTS beurteilt die klinische Relevanz der Daten stets im Zusammenhang mit:
- der zugrunde liegenden Erkrankung,
- ihrer Epidemiologie,
- sowie der therapeutischen Strategie, in die das digitale Medizinprodukt eingebettet ist.
Entscheidend ist zudem, ob sich die Ergebnisse auf das französische Gesundheitssystem übertragen lassen. Bei begrenzten Rekrutierungsmöglichkeiten können internationale multizentrische Studien akzeptiert werden. Voraussetzung ist aber, dass ihre Übertragbarkeit auf das französische System nachvollziehbar begründet werden kann.
7.2 Datenbasis
Grundsätzlich stützt sich die CNEDiMTS bevorzugt auf produktspezifische klinische Daten. In bestimmten Fällen können jedoch auch nicht-produktspezifische Daten berücksichtigt werden, etwa zu technologisch vergleichbaren Lösungen oder früheren Versionen des Produkts.
Voraussetzung ist in diesen Fällen:
- eine schlüssige Begründung der technischen Äquivalenz,
- eine transparente Analyse möglicher Unterschiede,
- sowie der Nachweis, dass diese Unterschiede keinen relevanten Einfluss auf den klinischen oder technischen Effekt haben.
7.3 Klinischer Nutzen und Endpunkte
Der klinische Nutzen wird immer im Vergleich zu einer relevanten Vergleichsalternative bewertet. Dabei berücksichtigt die CNEDiMTS sowohl positive Effekte als auch potenzielle Risiken der Anwendung.
Beispielhafte Bewertungsdimensionen im PECAN-Leitfaden des CNEDiMTS sind:
- Lebensqualität,
- Morbidität oder Mortalität,
- Komplikationen,
- Reduktion ungeplanter Krankenhausaufenthalte.
Wichtig ist, dass die gewählten Endpunkte zur beanspruchten Indikation und zum Wirkversprechen des Produkts passen. In der Praxis zeigt sich, dass formal korrekte, aber inhaltlich unpassende Endpunkte häufig zu kritischen Bewertungen führen.
7.4 Organisatorischer Nutzen als Innovationsargument
Neben dem klinischen Nutzen kann auch ein Fortschritt in der Organisation der Versorgung zur Begründung der Innovationsannahme herangezogen werden. Das kann etwa durch neue Versorgungsprozesse oder eine verbesserte Zugänglichkeit der Versorgung, insbesondere im Bereich der Teleüberwachung, geschehen.
Die CNEDiMTS stellt jedoch fest, dass dieser Nutzen in Anträgen häufig nur beschreibend, aber nicht systematisch belegt wird. Empfohlen wird daher, organisatorische Effekte strukturiert darzustellen, z. B. anhand der beteiligten Akteure, veränderter Prozesse und geeigneter Bewertungskriterien.
8. Akteure und Zuständigkeiten
Für das PECAN-Verfahren sind vor allem die folgenden Akteure im französischen Gesundheitssystem relevant:
- CNEDiMTS („Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé“ bzw. Nationale Kommission zur Bewertung von Medizinprodukten und Gesundheitstechnologien): Bewertet die medizinische und versorgungsbezogene Evidenz.
- ANS („Agence du Numérique en Santé“ bzw. Nationale Agentur für digitale Gesundheit): Prüft technische Anforderungen wie Datenschutz, Interoperabilität und IT-Sicherheit.
- Ministère chargé de la Santé & Ministère chargé de la Sécurité sociale (bzw. Ministerien für Gesundheit und soziale Sicherheit): Treffen die finale Entscheidung über die vorläufige Kostenübernahme und setzen diese per ministeriellem Erlass um, basierend auf den Stellungnahmen der CNEDiMTS und der ANS.
- HAS („Haute Autorité de Santé“ bzw. Französische Gesundheitsbehörde): Bietet u.a. sogenannte „frühe Beratungsgespräche“ an. Diese richten sich an Hersteller, deren Produkte sich noch in der klinischen Entwicklung befinden. Inhaltlich können dabei Fragen zur klinischen Evidenzstrategie besprochen werden, optional auch in Kombination mit gesundheitsökonomischen Themen (Effizienzbewertung). Wichtig: Die Gespräche sind optional, unverbindlich, vertraulich und kostenfrei. Sie gelten nicht als Bewertung und lassen keine Rückschlüsse auf die spätere Entscheidung der CNEDiMTS zu.
- G_NIUS („Guichet National de l’Innovation et des Usages en e-Santé“ bzw. Nationale Anlaufstelle für Innovation und Anwendungen im Bereich E-Health): Ist eine nationale Plattform zur Förderung von Innovationen im Bereich Digital Health. Sie unterstützt Entwickler und Hersteller insbesondere bei der Orientierung im regulatorischen Umfeld, der Identifikation von Finanzierungs- und Fördermöglichkeiten, sowie der Vernetzung mit relevanten Akteuren im französischen E-Health-Ökosystem. Ziel ist es, die Markteinführung neuer digitaler Technologien zu erleichtern und zu beschleunigen.
9. Stand 2026: DiGA-Verzeichnis von Frankreich
Obwohl das PECAN-Verfahren seit 2023 operativ verfügbar ist, spielt es in der Versorgungspraxis bislang nur eine untergeordnete Rolle. Anders als in Deutschland gibt es kein eigenständiges öffentliches DMD-Register. Digitale Medizinprodukte erscheinen nur indirekt in bestehenden Erstattungsstrukturen:
- LPPR (Liste des Produits et Prestations Remboursables): zentrales Erstattungsverzeichnis für alle Medizinprodukte, ohne Kennzeichnung digitaler Anwendungen
- LATM (Liste des Activités de Télésurveillance Médicale): Verzeichnis für erstattungsfähige Telemonitoring-Leistungen, ebenfalls ohne expliziten DMD-Status
Damit gibt es keine öffentliche Übersicht, welche DMD aktuell (vorläufig) erstattet werden.
Öffentlich nachvollziehbar ist bislang nur eine Anwendung, die tatsächlich über PECAN erstattet wurde:
Cureety TechCare
- Telemonitoring-Lösung für onkologische Patienten
- Aufnahme in PECAN: 2023
- kein Übergang in die dauerhafte Erstattung über die LATM
- Als wesentliche Gründe werden fehlende oder nicht ausreichend belastbare Nachweise zum langfristigen klinischen Nutzen und organisatorischen Mehrwert genannt.
10. Vergleich: DiGA Fasttrack vs. DMD und PECAN
Deutschland und Frankreich verfolgen das gleiche Ziel: digitale Medizinprodukte schneller in die Versorgung zu bringen. Der Unterschied liegt vor allem in Struktur, Transparenz und Preislogik.
- Erstattungslogik:
Sowohl das deutsche DiGA-Verfahren als auch das französische System sehen eine vorläufige Erstattung vor. In Deutschland sind die vorläufige und die dauerhafte Erstattung innerhalb desselben DiGA-Regelwerks verankert. In Frankreich ist die PECAN-Erstattung ausdrücklich als temporärer Einstieg konzipiert und auf zwölf Monate begrenzt. Eine dauerhafte Erstattung erfordert anschließend einen eigenständigen Antrag über LPPR oder LATM, also etablierte, nicht speziell auf digitale Anwendungen zugeschnittene Erstattungsmechanismen. - Erstattung:
In beiden Ländern übernehmen die gesetzlichen Krankenkassen die Kosten für die Erstattung. - CE-Zertifizierung:
In beiden Systemen ist die CE-Kennzeichnung nach MDR zwingend. - Klinische Evaluation:
Beide Verfahren arbeiten evidenzbasiert. DiGA zielt auf den positiven Versorgungseffekt, PECAN auf mutmaßliche Innovation plus belastbare Studienplanung. - Datenschutz & IT-Sicherheit:
Die Anforderungen sind in beiden Ländern vergleichbar hoch. Deutschland bündelt die Prüfung im DiGA-Verfahren. Frankreich trennt sie organisatorisch: klinisch über die CNEDiMTS, technisch über die ANS. - Risikoklassen:
In Deutschland ist der DiGA-Fast-Track auf Medizinprodukte der Risikoklassen I, IIa und IIb beschränkt. Produkte der Klasse III sind nicht inkludiert.
PECAN enthält keine formale Begrenzung der MDR-Risikoklasse. - Register & Transparenz:
In Deutschland gibt es mit dem DiGA-Verzeichnis ein eigenes, öffentliches Register ausschließlich für DiGA-Anwendungen. Ein vergleichbares, separates Verzeichnis für digitale Medizinprodukte existiert in Frankreich bislang nicht, wodurch ein transparenter Marktüberblick deutlich erschwert wird. - Preisbildung:
Im DiGA-Fast-Track können Hersteller den Preis während des Erprobungszeitraums unter Einhaltung der Höchstbeträge frei festlegen. Für die dauerhafte Listung müssen sie einen Vergütungsbetrag mit dem GKV-Spitzenverband verhandeln.
PECAN hingegen arbeitet in der vorläufigen Phase mit staatlich fixierten Pauschalen. Der endgültige Preis wird nach Ablauf des PECAN mit dem CEPS im Rahmen der regulären Erstattungswege verhandelt.

Unterschiede zwischen DMD und DiGA-Fast-Track
11. Von Deutschland nach Frankreich: DiGA zu PECAN
Nach dem Vergleich liegt der Gedanke nahe: Wenn eine DiGA in Deutschland funktioniert, warum nicht auch in Frankreich?
Auf dem Papier gibt es viele Parallelen: MDR-Basis, frühe Erstattung, Fokus auf Evidenz. Können deutsche DiGA-Hersteller also einfach mit den existierenden Produkten und Studien nach Frankreich gehen, um diesen neuen Markt zu erschließen?
In der Praxis scheint der Transfer leider nicht so einfach zu sein. Evidenz aus klinischen Studien in Deutschland wird in Frankreich ggf. nicht so einfach akzeptiert.
11.1 Beispiel: DiGA von „HelloBetter“ – Antrag auf PECAN-Erstattung
Das zeigt auch der Fall HelloBetter Insomnie. Als Hersteller von mehreren in Deutschland gelisteten DiGA reichte HelloBetter auch ein Dossier im PECAN-Verfahren ein.
Das Ergebnis war eine negative Stellungnahme der HAS und damit keine vorläufige Erstattung über PECAN. Als Begründung wurde angeführt, dass die vorgelegten Daten die erforderliche „Vermutung von Innovation“ nicht ausreichend belegen konnten. Damit sei kein ausreichender klinischer Nutzen bzw. Versorgungsfortschritt nachgewiesen worden.
Der Fall macht deutlich: DiGA-Evidenz aus Deutschland ist nicht automatisch PECAN-fähig. Unterschiede in Indikationsabgrenzung, Comparatoren, Versorgungslogik und Endpunkten spielen eine zentrale Rolle.
Stellungnahmen:
- Stellungnahmen der HAS finden Sie hier und hier
- Stellungnahmen des Herstellers „HelloBetter“ zu dieser Ablehnung finden Sie hier
11.2 Blick nach vorn: Deutsch-französische Annäherung
Trotz solcher Rückschläge ist die Richtung klar: Harmonisierung statt Insellösungen.
Der G-BA und die HAS arbeiten bereits an einer engeren Abstimmung, insbesondere bei:
- klinischen Evidenzanforderungen
- methodischen Standards
- technischer Bewertung digitaler Medizinprodukte
Ziel:
Hersteller sollen ihre Evidenz perspektivisch parallel für beide Märkte nutzen können.
12. Hilfreiche Links
Für weitere Informationen in Bezug auf die Erstattung von digitalen Gesundheitsanwendungen in Frankreich finden Sie hier eine Sammlung von wichtigen Links:
Links bezüglich PECAN-Verfahren:
- Rechtsgrundlage PECAN (CSS Art. L. 162-1-23): Der gesetzliche Rahmen für die vorläufige Kostenübernahme von DMD.
- PECAN-Leitfaden CNEDiMTS (HAS): Zentrales Dokument für Hersteller: Bewertungslogik, Anforderungen, Beispiele, typische Ablehnungsgründe.
- Arrêtés zur PECAN-Vergütung (DTx, Telemonitoring): Die Rechtsakte, die die Pauschalen/Parameter für die vorläufige Vergütung festlegen bzw. aktualisieren.
- PECAN-Übersicht (G_NIUS): Kurze, gut verständliche Zusammenfassung von PECAN inkl. Einordnung in die Erstattungslogik.
Links für Erstattung in der Regelversorgung (LPPR & LATM):
- HAS „Principes d’évaluation / DM pathway“ (2010 Guide): Überblick über Akteure und Erstattungswege rund um Medizinprodukte in Frankreich (v. a. MDR-Kontext/Marktüberwachung).
- LPPR/AMELI-Datenbank: Öffentliches Erstattungsumfeld für Medizinprodukte und Telemonitoring-Leistungen, ohne eigenes DMD-Register.
- LPPR-Leitfaden (HAS): Offizieller Leitfaden zur Antragstellung und Bewertung für die Aufnahme von Medizinprodukten in die LPPR.
- LPPR-Finanzierung (G_NIUS): Übersicht, wie Erstattung und Preislogik innerhalb der LPPR praktisch funktionieren.
- LATM-Leitfaden (HAS): Offizieller Leitfaden zur Einreichung eines Dossiers für Telemonitoring-Leistungen im LATM-Pfad.
- LATM-Finanzierung (G_NIUS): Erklärung der Vergütungslogik im Telemonitoring, inkl. Rollen, Pauschalen und Abrechnungsprinzip.
13. DiGA-Modelle in anderen Ländern
Immer mehr Länder planen einen standardisierten Prozess, um digitale Gesundheitsanwendungen in die Regelversorgung zu bringen. Neben Frankreich sollten Sie außerdem einen Blick in die folgenden Länder werfen:
- Belgien (Link zum Leitfaden für die Zulassung von DiGA in Belgien)
- Österreich (DiGA in Österreich: Zulassung digitaler Gesundheitsanwendungen (2026))
- Deutschland (Insider-Tipps für die Zulassung von DiGA in Deutschland)
- Schweiz (Erstattung von Digitalen Gesundheitsanwendungen (DiGA & dGA))
- Italien (Kommen DiGA bald nach Italien?)
- Erstattung von DiGA in der EU (Überblick über Zulassung von DiGA in allen Ländern der EU)
14. Fazit: Das DMD-Framework als DiGA mit Zusätzen
PECAN ist seit 2023 ein klar definiertes Verfahren, das Frankreich erstmals einen strukturierten Weg für die vorläufige Erstattung digitaler Medizinprodukte gibt.
Gleichzeitig zeigt die bisherige Praxis, dass PECAN aktuell noch kein verlässlicher Marktzugangspfad ist. Transparenz ist begrenzt, ein eigenes Register fehlt und öffentlich nachvollziehbare Erfolgsbeispiele scheint es kaum zu geben. Außerdem bleibt der Übergang in die dauerhafte Erstattung eine hohe Hürde, insbesondere wenn klinischer Nutzen oder organisatorischer Mehrwert nicht indikationsspezifisch und kurzfristig belastbar belegt werden können. Auch erfolgreiche DiGA-Evidenz aus Deutschland lässt sich nicht automatisch auf PECAN übertragen, wie der Fall von HelloBetter zeigt.
Für Hersteller heißt das: PECAN ist derzeit eher ein anspruchsvolles Übergangsinstrument als ein stabiler Erstattungskanal. Wer PECAN ernsthaft verfolgt, sollte auf eine belastbare Studienplanung achten und eine Strategie, die von Beginn an auf die dauerhafte Erstattung nach dem PECAN ausgerichtet ist.
Sie wollen eine digitale Anwendung auf den französischen Markt bringen?
Falls Sie die Zulassung einer digitalen Anwendung in Frankreich oder Deutschland planen, kontaktieren Sie uns gern. QuickBird Medical ist auf die auftragsbasierte Entwicklung und Zulassung von digitalen Gesundheitsanwendungen und Software-Medizinprodukten spezialisiert. Wir entwickeln Ihre Anwendung, lassen diese als Medizinprodukt nach MDR zu und führen Sie Schritt für Schritt durch das PECAN-Verfahren.




