In den letzten zehn Jahren haben wir eine Menge über die Entwicklung von Software-Medizinprodukten gelernt. Dieses Know-how geben wir gerne in unseren Fachartikeln an (angehende) Entwickler von Software as a Medical Device (SaMD) weiter, damit nicht jeder dieselben Lektionen selbst machen muss.
Wir entwickeln Software-Medizinprodukte für Start-ups, Pharmaunternehmen und andere Firmen und begleiten daher den gesamten Entwicklungszyklus dieser Produkte – von der ersten Idee bis zur dauerhaften Zulassung und darüber hinaus.
In diesem Beitrag möchten wir Ihnen einen Überblick über die Themen geben, zu denen wir bisher geschrieben haben.
Tipp: Wenn Sie neu in der Materie sind, macht es Sinn, dass Sie sich ganz einfach chronologisch von oben nach unten durch die Inhalte arbeiten.
Qualifizierung und Klassifizierung von Software-Medizinprodukten
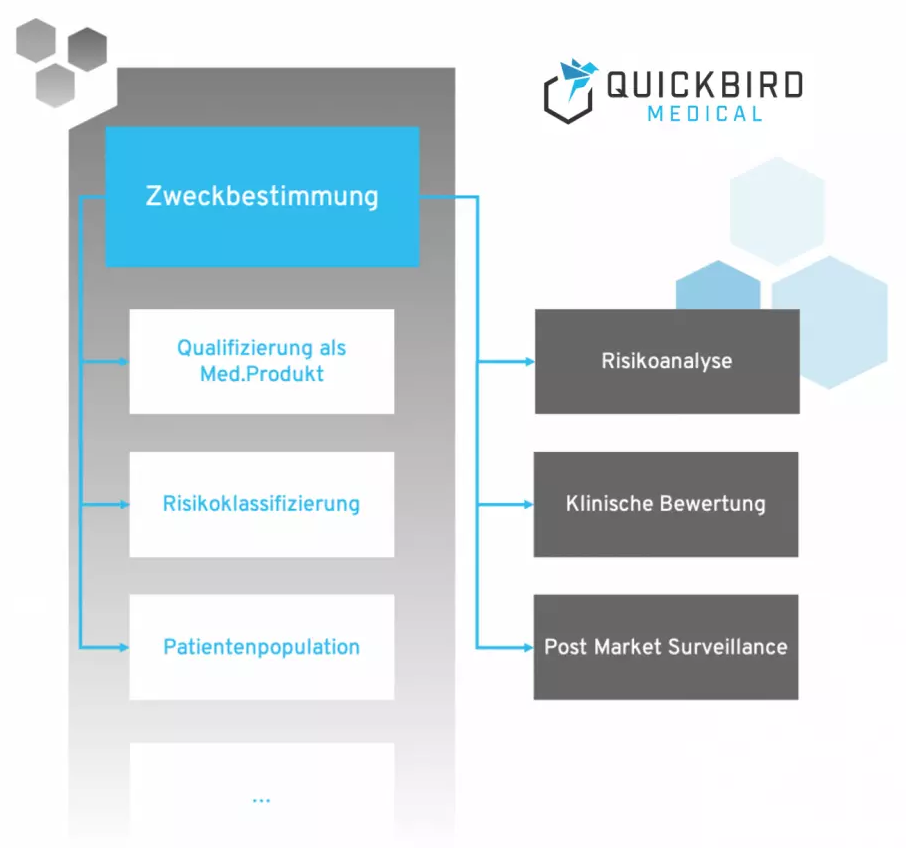
Zweckbestimmung und Qualifikation von Medizinprodukten
Formulierung der Zweckbestimmung für (Software-)Medizinprodukte
Zu Beginn jeder Medizinprodukt-Entwicklung sollte die Zweckbestimmung formuliert werden, welche auch als Basis für die Zuordnung zur Risikoklasse nach MDR dient:
Qualifizierung: Ist Ihre Software ein Medizinprodukt?
Nachdem Sie die Zweckbestimmung formuliert haben, stellt sich die Frage „Ist Ihre Software überhaupt ein Medizinprodukt nach MDR?“. Wenn dies nicht der Fall ist, müssen Sie sich auch nicht weiter mit der MDR auseinandersetzen.
Lesen Sie diesen Artikel, um dies für Ihr Produkt herauszufinden.
Klassifizierung von Software-Medizinprodukten: MDR-Leitfaden
Die Risikoklasse eines Medizinprodukts macht einen gewaltigen Unterschied für den notwendigen Aufwand und die Kosten, die Sie für die Zulassung investieren müssen. Sie sollten dies also vor Beginn der Produktentwicklung abklären.
MDR Risikoklasse I vs. IIa: Unterschiede für Software-Medizinprodukte
Gerade zwischen Risikoklasse I und Risikoklasse IIa existieren enorme Unterschiede für Kosten und Zeitplan im Rahmen der Produktentwicklung. Was sind die Unterschiede für Sie in der Praxis?
Klasse I Software nach MDR – Geht das noch? (Januar 2025)
Wir gehen darauf ein, welche Software-Medizinprodukte Stand 2025 noch in Klasse I fallen können.
Leitfäden zu Aspekten der Entwicklung und Zulassung von SaMD

Timeline: Der Weg zur Medizinproduktzulassung
Zulassung & Zertifizierung von Software-Medizinprodukten (MDR)
Hier gehen wir einen holistischen Überblick über alle Aspekte der Zulassung von Software as a Medical Device (SaMD) ein.
IEC 62304: Software-Lebenszyklus-Prozesse von Medizinprodukten
Die IEC 62304 ist die wohl zentralste Norm zur Entwicklung von Software-Medizinprodukten. Doch wie genau lässt sich diese in die Praxis umsetzen und lässt sich dies mit agiler Entwicklung vereinen?
ISO 13485 – Leitfaden zu Anforderungen und Inhalten
Das Qualitätsmanagementsystem eines SaMD-Herstellers sollte mit der ISO 13485 im Rahmen der MDR im Einklang stehen. Dies stellt die wichtigste Norm für die Konformität von Qualitätsmanagementsystemen für Medizinprodukte dar.
Software als Medizinprodukt: 11 Zertifizierungs-Tipps für Hersteller
Seit über 10 Jahren entwickeln wir Software-Medizinprodukte auf Auftragsbasis für andere Unternehmen. Wir haben hier unsere wichtigsten Learnings und Tipps für zukünftige Hersteller aufgeschrieben.
Validierung von Medizinprodukt-Software nach MDR
Bevor ein Software-Medizinprodukt auf den Markt gehen kann, muss es formal validiert werden. Was das genau bedeutet, erfahren Sie hier.
MDR-Guide: Klinische Bewertung von Software-Medizinprodukten
Die klinische Bewertung ist das Kernstück der Validierung von Software-Medizinprodukt und stellt manch einen Hersteller vor große Herausforderungen. Wir gehen darauf ein, was Sie in diesem Rahmen tun müssen. Außerdem erklären wir, wann Sie eine klinische Studie/Prüfung durchführen müssen und wann eine Literaturrecherche ausreicht.
Künstliche Intelligenz (KI) in Medizinprodukten – MDR Leitfaden (2025)
Auch MDR-Medizinprodukte dürfen natürlich Künstliche Intelligenz (KI) enthalten. Doch die Zulassung derartiger Produkte bringt eine Reihe von zusätzlichen Herausforderungen mit sich. Hier gehen wir darauf ein, was Sie bei der Entwicklung von KI-Medizinprodukten beachten sollten.
Software-Medizinprodukte ohne Qualitätsmanagement & Regulatorik zulassen?
DiGA und die Medical Device Regulation (MDR) bringen für Hersteller eine Menge Herausforderungen mit sich – von der Einrichtung eines Qualitätsmanagementsystems (QMS) bis zur Erstellung der technischen Dokumentation. Kein Wunder, dass sich viele Unternehmen fragen, ob sie diese Komplexität auslagern können.
Die gute Nachricht: Ja, das geht! Indem die Rolle des Legalherstellers an einen externen Anbieter übertragen wird, lassen sich die regulatorischen Anforderungen komplett an eine dritte Partei auslagern.
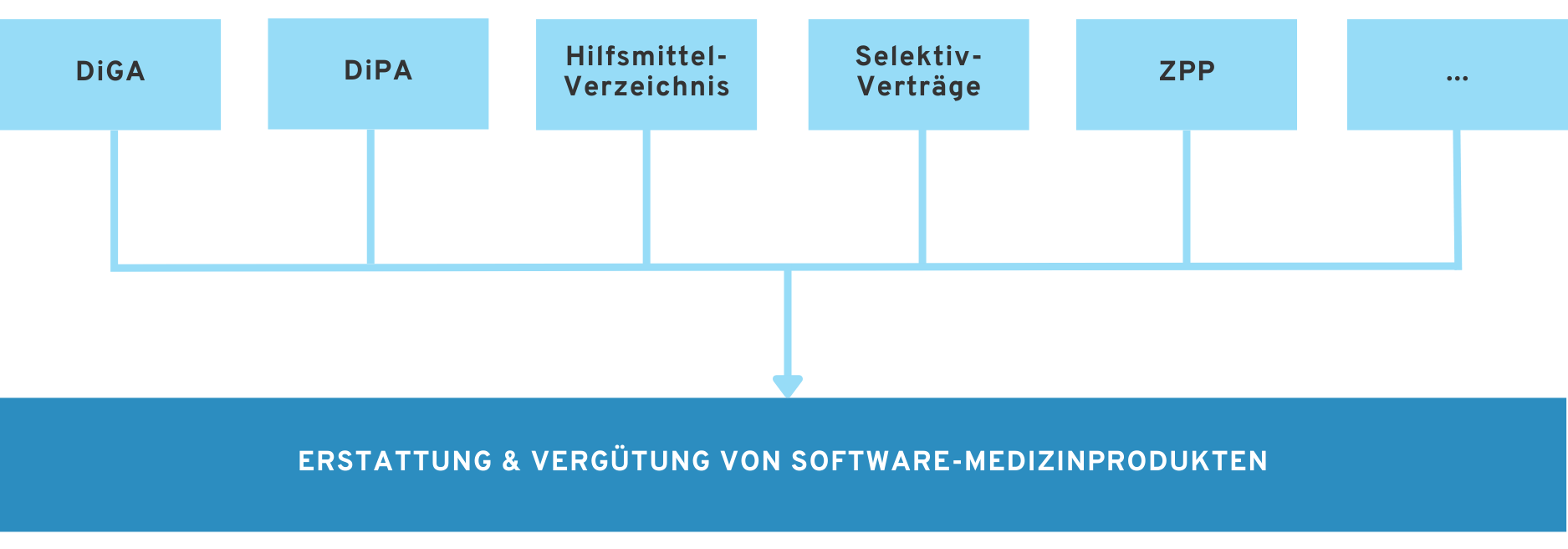
Erstattung & Vergütung von Software-Medizinprodukten
In unserem Whitepaper „Alle Wege in die Kostenerstattung für medizinische Software und Gesundheits-Apps (in 2025)“ erhalten Sie einen Überblick über sämtliche Wege in die Kostenerstattung
Die Zulassung als Medizinprodukt nach MDR befähigt Sie, Ihr Produkt auf dem Markt zu vertreiben. Das heißt aber noch nicht, dass Sie damit auch Geld verdienen.
Gerade im deutschen Gesundheitssystem ist es oft ratsam, einen Weg in die Erstattung durch Krankenkassen für Ihr Produkt zu finden. Hierfür gibt es je nach Art des Software-Produkts eine Palette an Erstattungsoptionen.
Die folgenden Leitfäden geben Ihnen einen Überblick über wichtige Wege für Software-Produkte in die Erstattung.
Digitale Gesundheitsanwendungen – unsere detaillierten Leitfäden
Die Zulassung als DiGA stellt für Patienten-orientierte Applikationen bzw. DTx den wohl beliebtesten Weg in die Erstattung dar. Die Zulassung ist aber alles andere als einfach und bringt enorme regulatorische Hürden mit sich. Wir haben zu vielen Aspekten der Zulassung Fachartikel geschrieben, um Herstellern mit Zusatzinformationen zu unterstützen.
→ Link zu allen Insights zur DiGA-Entwicklung und Zulassung in 2025
Selektivverträge mit Krankenkassen: Die Alternative zu DiGA
Selektivverträge mit Krankenkassen eigenen sich für eine breite Palette von SaMD und sind ein populärer Weg in die Erstattung.
Zertifizierung digitaler Kurse nach ZPP – Zentrale Prüfstelle Prävention
Hersteller von Produkten, die sich auf die Prävention von Krankheiten konzentrieren, sollten sich mit der Zentralen Prüfstelle Prävention auseinandersetzen. Dies stellt einen möglichen Weg dar, die Kosten von derartigen Anwendungen (teilweise) zu vergüten.
DiPA: digitale Anwendungen für die Pflege
Das Pendant zur DiGA in der Pflege sind die DiPA. Wie Sie DiPA potenziell in die Erstattung bringen, erfahren Sie hier.
Erstattung von Software im GKV-Hilfsmittelverzeichnis (HMV)
Software-Produkte, die sich als Hilfsmittel qualifizieren und z.B. eine Fehlfunktion des Körpers ausgleichen, können potenziell ins Hilfsmittelverzeichnis aufgenommen werden. Dies stellt einen weiteren Weg in die Erstattung durch Krankenkassen dar.
Innovationsfonds und weitere Förderungen für Gesundheitssoftware
Für Hersteller digitaler Gesundheitslösungen existieren verschiedene öffentliche Förderprogramme – je nach Projektfokus, Reifegrad und Zielmarkt. Eine der zentralen und praxisrelevantesten Förderquellen im deutschen Gesundheitswesen ist dabei zweifellos der Innovationsfonds des G-BA, der gezielt neue Versorgungsformen unterstützt und gerade für Softwareprojekte mit Versorgungsbezug attraktive Möglichkeiten bietet.
Weitere aktuelle Informationen zur Entwicklung von Medizinprodukt-Software und DiGA
In die Erstellung der Leitfäden und Artikel haben wir viel Arbeit und Zeit investiert. Wir hoffen, dass sie Ihnen als Hersteller bei Ihren Herausforderungen Unterstützung bieten können.
Als zusätzliches Angebot empfehlen wir Ihnen unseren Newsletter, in dem wir monatlich detaillierte Berichte zu aktuellen Themen im Bereich der und Medizinprodukt-Software- und DiGA-Entwicklung versenden.
Hier können Sie sich für den Newsletter anmelden: zum Newsletter
Aktuelle Entwicklungen und Nachrichten zum Thema DiGA & Medical Software finden Sie auch auf unserer News-Seite.




