Wir durften seit Beginn des DiGA-Konzepts sehr, sehr viel über die Entwicklung digitaler Gesundheitsanwendungen lernen. Dieses Wissen teilen wir möglichst viel über unsere Fachartikel mit (angehenden) DiGA-Herstellern. So muss nicht jeder alle schmerzhaften Learnings doppelt und dreifach selbst machen.
Da wir DiGA auf Auftragsbasis für Start-ups, Pharma und andere Unternehmen entwickeln, sehen wir den kompletten Entwicklungszyklus einer DiGA: von der ersten Idee bis zur dauerhaften Zulassung und danach.
In diesem Beitrag möchten wir Ihnen einen Überblick über alle Themen geben, über die wir bereits geschrieben haben. Sie finden eine Übersicht aller Leitfäden und Fachartikel, eingeordnet nach Themengebiet.
Tipp: Wenn Sie neu in der Materie sind, macht es Sinn, dass Sie sich ganz einfach chronologisch von oben nach unten durch die Inhalte arbeiten.
Inhaltsverzeichnis
- 1. DiGA: Entwicklung & Zulassung
- 1.1 Ist Ihre App eine DiGA? Definition & Kriterien digitaler Gesundheitsanwendungen
- 1.2 12 wichtige Empfehlungen für angehende DiGA-Hersteller
- 1.3 Leitfaden zur DiGAV: Digitale-Gesundheitsanwendungen-Verordnung
- 1.4 DiGA: Leitfaden zum Nachweis positiver Versorgungseffekte
- 1.5 DiGA-Leitfaden: Historie aller Änderungen
- 1.6 Interoperabilität für digitale Gesundheitsanwendungen (DiGA)
- 1.7 Datensicherheits- & Datenschutz-Zertifikate für DiGA
- 1.8 DiGA & Software-Medizinprodukte ohne Qualitätsmanagement & Regulatorik zulassen?
- 1.9 BSI TR-03161 für DiGA: Zertifizierung der Datensicherheit
- 2. DiGA: Finanzen, Businessmodell, Marketing und Vertrieb
- 3. DiGA: Statistiken und Marktsituation
- 4. DiGA: Modelle in Europa
- 5. Medizinprodukt-Entwicklung und Zulassung
- 6. Alternative Erstattungsoptionen zu DiGA
- 6.1 Selektivverträge mit Krankenkassen: Die Alternative zu DiGA
- 6.2 Zertifizierung digitaler Kurse nach ZPP – Zentrale Prüfstelle Prävention
- 6.3 DiPA: Digitale Anwendungen für die Pflege
- 6.4 Erstattung von Software im GKV-Hilfsmittelverzeichnis (HMV)
- 6.5 Innovationsfonds und weitere Förderungen für Gesundheitssoftware
- 7. Weitere aktuelle Informationen zur Entwicklung von DiGA und Medizinprodukt-Software
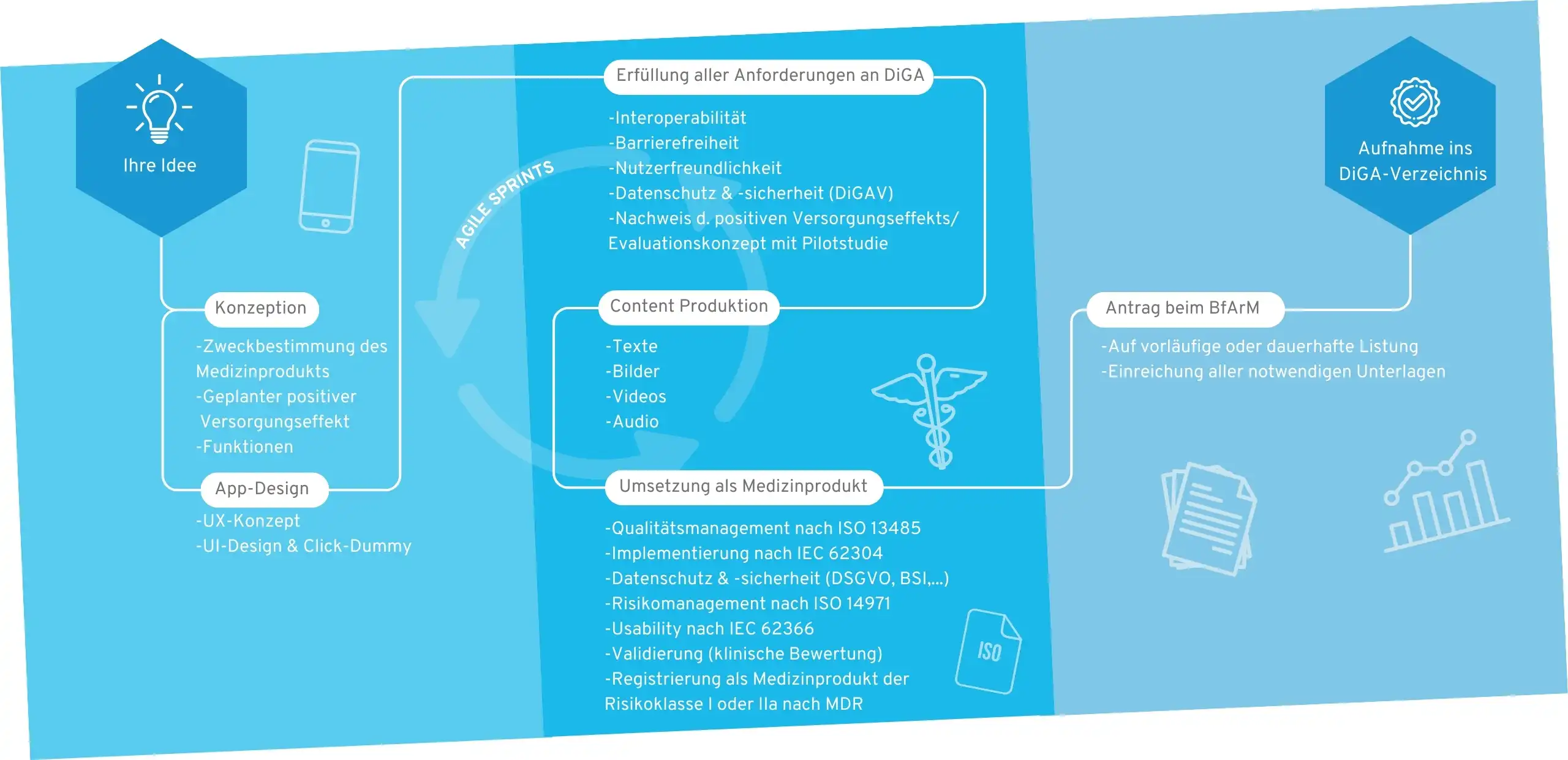
1. DiGA: Entwicklung & Zulassung
Der Weg ins DiGA-Verzeichnis
Die folgenden Fachartikel & Leitfäden beschäftigen sich mit verschiedenen Aspekten der technischen und regulatorischen Entwicklung von DiGA:
1.1 Ist Ihre App eine DiGA? Definition & Kriterien digitaler Gesundheitsanwendungen
Zu Beginn Ihrer Planung stellt sich erstmal die Frage: Ist Ihre Anwendung überhaupt eine DiGA? Erfüllen Sie also alle Kriterien, um sich als DiGA zu qualifizieren?
1.2 12 wichtige Empfehlungen für angehende DiGA-Hersteller
Bevor Sie in die Entwicklung einer DiGA einsteigen, sollten Sie von Fehlern anderer DiGA-Hersteller lernen, um diese für Ihr eigenes Vorhaben zu vermeiden. Wir geben exklusive Einblicke und wichtige Empfehlungen aus der Praxis, die Sie bei Ihrer Planung beachten sollten:
1.3 Leitfaden zur DiGAV: Digitale-Gesundheitsanwendungen-Verordnung
Die DiGAV stellt die Grundlage für die gesetzlichen Anforderungen an digitale Gesundheitsanwendungen dar. Sie erhalten hier einen Überblick, was diese Anforderungen sind.
1.4 DiGA: Leitfaden zum Nachweis positiver Versorgungseffekte
In diesem Artikel geben wir Ihnen einen detaillierten Leitfaden darüber, wie der Nachweis positiver Versorgungseffekte zu erfolgen hat. Dies inkludiert Pilotstudie, Evaluationskonzept und die vollumfängliche Studie zur dauerhaften Aufnahme der DiGA.
1.5 DiGA-Leitfaden: Historie aller Änderungen
Der offizielle DiGA-Leitfaden ist wohl das wichtigste Dokument, das jeder DiGA-Hersteller gelesen haben sollte. Das BfArM aktualisiert diesen Leitfaden auch regelmäßig. Hierfür gibt es aber bisher leider keine detaillierte Änderungshistorie. Daher untersuchen wir alle Änderungen am DiGA-Leitfaden laufend stellen hier alle Änderungen mit Bildern und Kommentaren übersichtlich für Sie dar.
1.6 Interoperabilität für digitale Gesundheitsanwendungen (DiGA)
An eine DiGA werden gesetzlich eine Reihe von Interoperabilitätsanforderungen gestellt. In diesem Artikel erfahren Sie mehr über diese Anforderungen und erhalten praktische Einblicke in die Implementierung von Interoperabilitätsstandards für eine DiGA.
1.7 Datensicherheits- & Datenschutz-Zertifikate für DiGA
Digitale Gesundheitsanwendungen müssen strenge Datenschutz- und Datensicherheitsstandards erfüllen, um die Integrität und Vertraulichkeit patientenbezogener Daten zu gewährleisten. In unserem Artikel erhalten Sie einen umfassenden Überblick über die notwendigen Zertifikate und wie diese erlangt werden können.
1.8 DiGA & Software-Medizinprodukte ohne Qualitätsmanagement & Regulatorik zulassen?
DiGA und die Medical Device Regulation (MDR) konfrontieren Hersteller mit umfassenden Herausforderungen. Dies umfasst den Aufbau eines Qualitätsmanagementsystems (QMS), das Erstellen detaillierter technischer Dokumentation sowie das Management erhöhter regulatorischer Haftungsrisiken. In diesem Zusammenhang überlegen viele Unternehmen, ob sie die umfangreichen regulatorischen Anforderungen für Medizinprodukte vollständig an einen externen Anbieter delegieren können.
Dies ist tatsächlich vollständig möglich, indem die Rolle des Legalherstellers an ein externes Unternehmen ausgelagert wird.
1.9 BSI TR-03161 für DiGA: Zertifizierung der Datensicherheit
Seit dem 01.01.2025 müssen Hersteller digitaler Gesundheitsanwendungen (DiGA) die Erfüllung der Datensicherheitsanforderungen durch ein offizielles Zertifikat nachweisen. Als Basis der Zertifizierung wird die BSI TR-03161 herangezogen, welche 2020 erstmals veröffentlicht wurde.
Auf Basis unserer praktischen Erfahrungen aus mehreren durchgeführten TR-03161-Projekten schildern wir den aktuellen Stand der Zertifizierungsanforderungen.
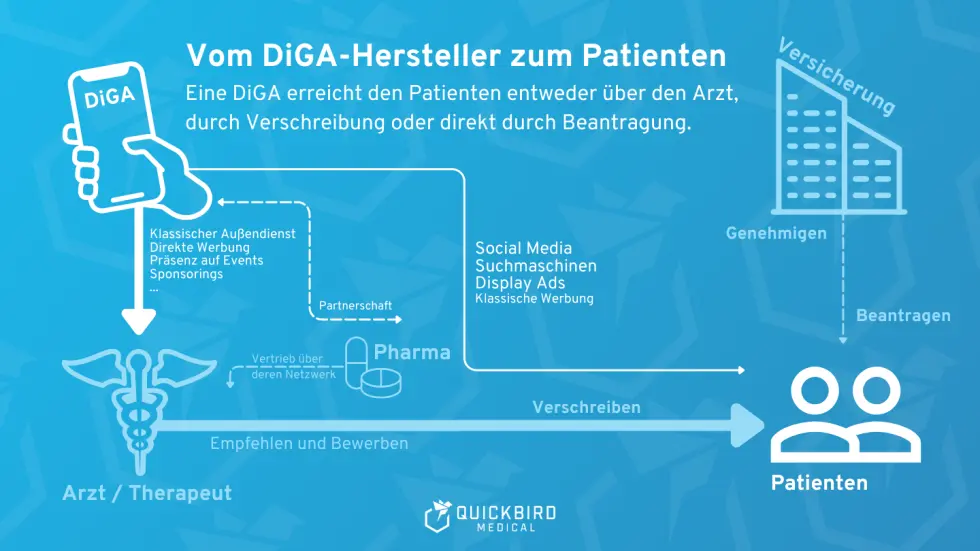
2. DiGA: Finanzen, Businessmodell, Marketing und Vertrieb
Grafik zu den möglichen DiGA-Vetriebswegen
2.1 DiGA-Preisverhandlung mit dem GKV-Spitzenverband
In diesem Artikel wird beschrieben, wie Preisverhandlungen für DiGA mit dem GKV-Spitzenverband geführt werden. Er erklärt die Unterschiede zwischen der vorläufigen und der dauerhaften Aufnahme einer DiGA ins Verzeichnis und die damit verbundenen Zeitfenster für den Beginn der Verhandlungen. Der Artikel gibt einen Überblick über die notwendigen Unterlagen und die Dauer der Verhandlungen sowie die Rolle der Schiedsstelle bei nicht erzielten Einigungen.
2.2 Wie Sie DiGA-Daten für Vertrieb und R&D von Arzneimitteln nutzen können
Pharmazeutische Unternehmen ziehen großen Nutzen aus Real-World-Daten über die Zielgruppen ihrer Arzneimittel. Solche Daten sind besonders wertvoll für den Vertrieb bestehender Medikamente und die Entwicklung neuer Produkte.
Aber wie kann man mit einer DiGA Daten erheben, die dann z.B. für die Versorgungsforschung von Arzneimitteln verwendet werden können?
2.3 DiGA Umsatz & Kosten: Lohnt sich eine DiGA?
Beim Start einer DiGA ist es wichtig, das finanzielle Potenzial zu bewerten. Die zentrale Frage lautet: Ist die Entwicklung Ihrer DiGA-Idee finanziell sinnvoll? Dies fragen sich auch potenzielle Investoren. Sie sollten daher überzeugende Kalkulationen präsentieren, die Gewinn, Umsatzpotential, Marktpotenzial und Kosten umfassen. Dieser Artikel bietet Ihnen eine detaillierte Anleitung und Beispielrechnungen, um das Potenzial Ihrer DiGA für die gewählte Krankheitsindikation genau zu ermitteln.
2.4 Leitfaden: DiGA-Marketing und Vertrieb
Auch wenn alle regulatorischen Anforderungen erfüllt sind und Ihre DiGA im zentralen Verzeichnis gelistet wird, ist ein erfolgreicher Markteintritt damit noch nicht garantiert. Der bloße Eintrag bedeutet nicht automatisch, dass Ärzte Ihre DiGA verschreiben werden. Deshalb ist die Auswahl effektiver Marketing- und Vertriebsstrategien entscheidend, um das gesamte Marktpotenzial Ihrer Nische zu nutzen. Die Bandbreite der Möglichkeiten ist groß und das Marktumfeld komplex. Dieser Artikel bietet Ihnen einen Überblick und praktische Tipps.
3. DiGA: Statistiken und Marktsituation
3.1 Das DiGA-Verzeichnis für Hersteller
Digitale Gesundheitsanwendungen (DiGA) lassen sich anhand verschiedener Kriterien wie der Medizinprodukt-Risikoklasse, der zuständigen Aufsichtsbehörde, der Dauer der DiGA-Verordnung oder des Listenpreises vergleichen. Unser DiGA-Analyzer bietet im Gegensatz zum BfArM-Verzeichnis speziell für Hersteller angepasste Suchfilter, die eine gezielte Marktanalyse ermöglichen.
→ Link zur DiGA-Verzeichnis-Analyse
DiGA-Statistiken: Aktuelle gelistete DiGA
DiGA Statistiken: Das DiGA-Verzeichnis in Zahlen
Analysieren Sie das DiGA-Verzeichnis mithilfe unseres Echtzeit-Dashboards. Entdecken Sie aktuelle Informationen zur Verteilung der Risikoklassen, den Preisen und Kosten, der Verordnungsdauer und weiteren wichtigen Statistiken über die DiGA-Landschaft.
→ Link zu den DiGA-Statistiken
3.2 Aktuelle DiGA-Reports 2025: Offizielle Berichte im Überblick
Die aktuellsten Zahlen und Berichte für zugelassene digitale Gesundheitsanwendungen (DiGA) sind für die strategische Planung und Marktanalyse neuer DiGA-Projekte von großer Bedeutung.
Verschreibungszahlen und weitere Statistiken finden Sie in Berichten verschiedener Institutionen wie dem GKV-Spitzenverband oder dem Spitzenverband Digitale Gesundheitsversorgung.
Da die Informationen verstreut sein können, bieten wir Ihnen in diesem Beitrag einen chronologischen Überblick und verlinken direkt zu den DiGA-Reports der wichtigsten Herausgeber.
4. DiGA: Modelle in Europa
Deutschland hat 2019 Pionierarbeit geleistet, indem es ein standardisiertes Modell für die Zulassung digitaler Gesundheitsanwendungen (DiGA) einführte. In der Folge ziehen nun andere Länder in Europa nach und entwickeln ebenfalls DiGA-Modelle oder haben bereits solche implementiert.
In den folgenden Artikeln und Whitepapern werfen wir einen Blick darauf, für welche Länder …
… bereits ein DiGA-Modell existiert,
… ein DiGA-Modell geplant wird,
… oder keinerlei DiGA-Modell in Aussicht steht.
→ DiGA & DTX in Italien
→ DiGA & DTX in Österreich: Zulassung digitaler Gesundheitsanwendungen (2025)
→ DiGA & DT in der Schweiz
→ DiGA & DTX in Frankreich
→ DiGA & DTX in Belgien
→ DiGA & DTX in der EU: Der DiGA-Fast-Track – bald auch europaweit?
5. Medizinprodukt-Entwicklung und Zulassung
Vor der Zulassung als DiGA muss Ihr Produkt als Medizinprodukt nach Medical Device Regulation (MDR) zugelassen sein. Dies bringt zusätzlich zu den Anforderungen der DiGA-Verordnung viele Herausforderungen im Rahmen der MDR mit sich.
Wir haben eine Vielzahl von Fachartikeln geschrieben, welche sich speziell mit der Zulassung von Software-Medizinprodukten beschäftigen.
→ Link zur Übersicht über alle Artikel zur Medizinprodukt-Entwicklung und Zulassung
6. Alternative Erstattungsoptionen zu DiGA
In unserem Whitepaper „Alle Wege in die Kostenerstattung für medizinische Software und Gesundheits-Apps (in 2025)“ erhalten Sie einen Überblick über sämtliche Wege in die Kostenerstattung.
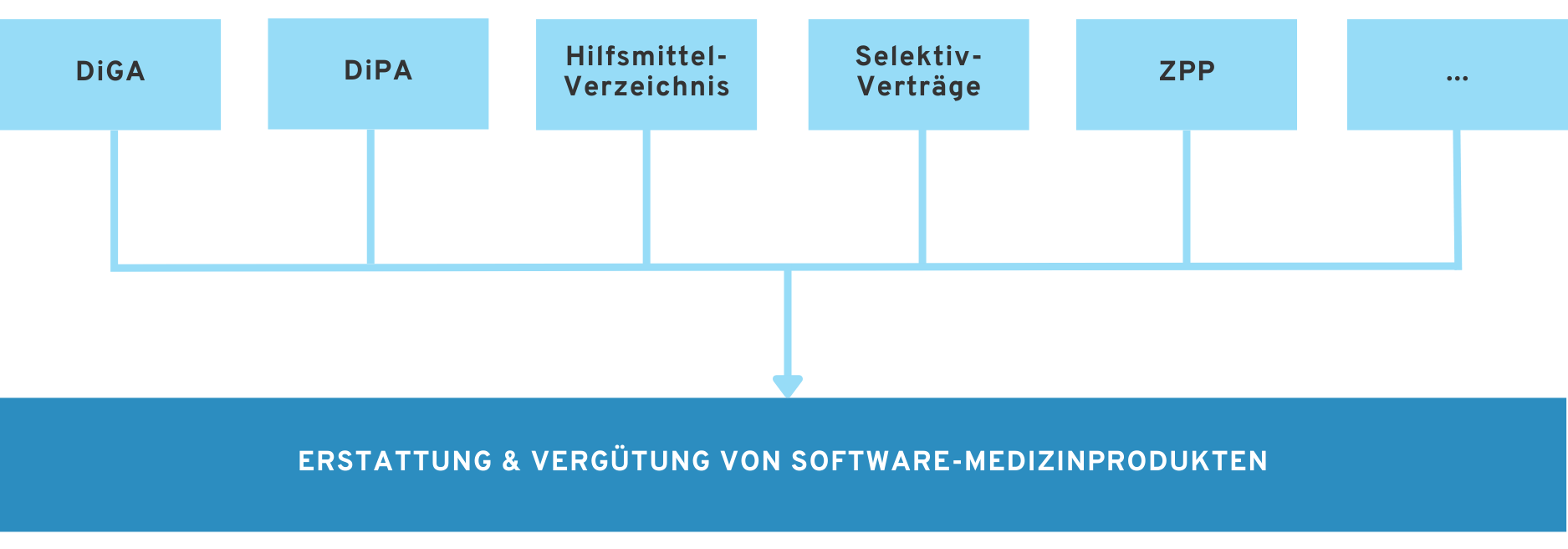
Neben der Zulassung als DiGA gibt es eine Reihe weiterer Wege, um DTx bzw. digitale Lösungen in die Erstattung durch Krankenkassen zu bringen. Nicht für jeden Hersteller ist der DiGA-Zulassungsprozess der beste Weg.
In den folgenden Artikeln gehen wir auf andere Erstattungsoptionen im deutschen Gesundheitssystem ein.
6.1 Selektivverträge mit Krankenkassen: Die Alternative zu DiGA
Selektivverträge sind eine spannende Alternative zum stark regulierten DiGA-Zulassungsprozess.
6.2 Zertifizierung digitaler Kurse nach ZPP – Zentrale Prüfstelle Prävention
Hersteller, die Produkte zur Krankheitsprävention entwickeln, sollten die Zertifizierungsmöglichkeiten durch die Zentrale Prüfstelle Prävention erwägen.
6.3 DiPA: Digitale Anwendungen für die Pflege
DiPA ist das Äquivalent zur DiGA im Pflegebereich. Erfahren Sie, wie Sie DiPA in die Erstattung bringen können.
6.4 Erstattung von Software im GKV-Hilfsmittelverzeichnis (HMV)
Softwareprodukte, die als medizinische Hilfsmittel gelten und beispielsweise körperliche Beeinträchtigungen ausgleichen, könnten in das Hilfsmittelverzeichnis aufgenommen werden. Dies eröffnet einen weiteren Weg zur Erstattung durch Krankenkassen.
6.5 Innovationsfonds und weitere Förderungen für Gesundheitssoftware
Für Hersteller digitaler Gesundheitslösungen existieren verschiedene öffentliche Förderprogramme – je nach Projektfokus, Reifegrad und Zielmarkt. Eine der zentralen und praxisrelevantesten Förderquellen im deutschen Gesundheitswesen ist dabei zweifellos der Innovationsfonds des G-BA, der gezielt neue Versorgungsformen unterstützt und gerade für Softwareprojekte mit Versorgungsbezug attraktive Möglichkeiten bietet.
7. Weitere aktuelle Informationen zur Entwicklung von DiGA und Medizinprodukt-Software
In die Leitfäden und Artikel ist viel Arbeit und Zeit geflossen. Wir hoffen, dass diese Ihnen als Hersteller bei Ihren Herausforderungen ein wenig helfen können.
Zuletzt können wir Ihnen noch unseren Newsletter empfehlen, wo wir monatlich einen detaillierten Bericht zu aktuellen Themen im Bereich der DiGA- und Medizinprodukt-Entwicklung versenden: Zum Newsletter
Aktuelle Entwicklungen und Nachrichten zum Thema DiGA & Medical Software finden Sie auch auf unserer News-Seite.